
 5 kJ/mol
5 kJ/mol | A���Ӵ���ͬʱ�����¶� | B���Ӵ���ͬʱ����ѹǿ |
| C�������¶�ͬʱ����N2 | D�������¶�ͬʱ����ѹǿ |
 ��������ţ�
��������ţ�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.3mol | B��0.15mol |
| C���� 0.15mol | D������0.15mol���� 0.3mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2Z(g)�ﵽƽ��ʱ�������ʵ�ƽ��Ũ��Ϊc(X)=0.5mol/L��c(Y) ="0.1" mol /L ; c (Z)="1.6" mol /L����a���⡢�㡡�ֱ��ʾX��Y�� Z�ij�ʼŨ�ȣ�mol/L����ᡢ��Ӧ����Ĺ�ϵ��________ ____, a��ȡֵ��ΧΪ_______________
2Z(g)�ﵽƽ��ʱ�������ʵ�ƽ��Ũ��Ϊc(X)=0.5mol/L��c(Y) ="0.1" mol /L ; c (Z)="1.6" mol /L����a���⡢�㡡�ֱ��ʾX��Y�� Z�ij�ʼŨ�ȣ�mol/L����ᡢ��Ӧ����Ĺ�ϵ��________ ____, a��ȡֵ��ΧΪ_______________ dD(g)��eE(g)������ƽ���ά���¶Ȳ����ѹǿ�ı䣬���D��Ũ�ȱ仯���£�
dD(g)��eE(g)������ƽ���ά���¶Ȳ����ѹǿ�ı䣬���D��Ũ�ȱ仯���£�| ѹǿ��Pa�� | 4��105 | 6��105 | 10��105 | 20��105 |
| D��Ũ�ȣ�mol/L�� | 0.085 | 0.126 | 0.200 | 0.440 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ��8mol
��8mol ��һ�������·�Ӧ���ﵽƽ��ʱ��
��һ�������·�Ӧ���ﵽƽ��ʱ�� ��ת����Ϊ25������ƽ��ʱ��������������ӽ���
��ת����Ϊ25������ƽ��ʱ��������������ӽ��� | A��5�� | B��10�� | C��15�� | D��20�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3��������ͼ�жϣ�
2NH3��������ͼ�жϣ�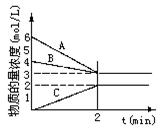
 2C�ﵽ�˻�ѧƽ��״̬�������ƽ��ʱC��A2��= 0.5mol��L��C��B2��="0.1mol/L" C��C��=" 1.6" mol/L����A2��B2��C����ʼŨ�ȷֱ���a mol/L��b mol/L��cmol/L��ʾ����ش�
2C�ﵽ�˻�ѧƽ��״̬�������ƽ��ʱC��A2��= 0.5mol��L��C��B2��="0.1mol/L" C��C��=" 1.6" mol/L����A2��B2��C����ʼŨ�ȷֱ���a mol/L��b mol/L��cmol/L��ʾ����ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
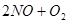

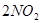 �ﵽƽ��ı�־��
�ﵽƽ��ı�־��| A��NO��O2��NO2������Ŀ����2:1:2 |
| B����Ӧ������и�������ʵ�Ũ����� |
| C������������ɫ���ٱ仯 |
| D����������ƽ����Է��������ı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 H2(g) + CO2(g) ��H=" Q" kJ��mol-1����ƽ�ⳣ�����¶ȵı仯���±���
H2(g) + CO2(g) ��H=" Q" kJ��mol-1����ƽ�ⳣ�����¶ȵı仯���±���| �¶�/�� | 400 | 500 | 850 |
| ƽ�ⳣ�� | 9.9 4 4 | 9 | 1 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 �����ƶ���T��ʱ��M��
�����ƶ���T��ʱ��M�� N���������о�������ӦN2��g��+3H2��g��
N���������о�������ӦN2��g��+3H2��g��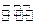 2NH3��g����������M��N�и�����l mol N2��3 mol H2����ʼM��N���ݻ����¶���ͬ���������¶Ȳ��䡣�����й�˵���в���ȷ���� �� ��
2NH3��g����������M��N�и�����l mol N2��3 mol H2����ʼM��N���ݻ����¶���ͬ���������¶Ȳ��䡣�����й�˵���в���ȷ���� �� ��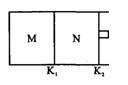
A����Ӧ�ﵽƽ��ʱN2��ת���ʣ�M>N |
| B��H2�����������M>N |
C������N�дﵽƽ�⣬��������к���1��2mol NH3����ʱN���ݻ�ΪVL����÷�Ӧ�ڴ������µ�ƽ�ⳣ��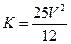 |
| D���÷�Ӧ��T��ʱ��ƽ�ⳣ��K��M=N |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 xC(g)��2D(g)����5 min���D��Ũ��Ϊ0.5 mol/L��c(A)��c(B)��3��5��C��ƽ����Ӧ������0.1mol/(L��min)����5minʱ��A��Ũ��Ϊ___ ___��B��ƽ����Ӧ����Ϊ____ __��x��ֵ��__ ____��
xC(g)��2D(g)����5 min���D��Ũ��Ϊ0.5 mol/L��c(A)��c(B)��3��5��C��ƽ����Ӧ������0.1mol/(L��min)����5minʱ��A��Ũ��Ϊ___ ___��B��ƽ����Ӧ����Ϊ____ __��x��ֵ��__ ____���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com