
【题目】尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示. 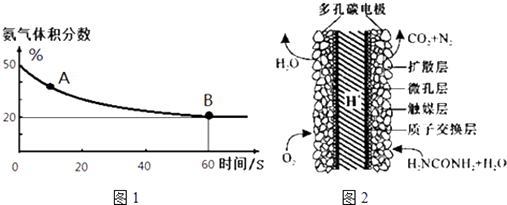
A点的正反应速率v正(CO2)B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为 .
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)将实验测得的不同温度下的平衡数据列于表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度 (10﹣3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①关于上述反应的焓变、熵变说法正确的是 .
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=;(填具体数值)NH4+水解平衡常数值为 .
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式: .
【答案】
(1)大于;75%
(2)A;C;0.1mol/L;4×10﹣9
(3)CO(NH2)2+H2O﹣6e﹣=CO2+N2+6H+
【解析】解:(1.)氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率,故v正(CO2)>v逆(CO2);
设氨气消耗物质的量x,开始氨气体积分数为50%,假设氨气为50mol,二氧化碳为50mol,
CO2 | + | 2NH3 | (NH2)2CO | + | H2O | ||
起始量(mol) | 50 | 50 | 0 | 0 | |||
变化量(mol) | 0.5x | x | 0.5x | 0.5x | |||
平衡量(mol) | 50﹣0.5x | 50﹣x | 0.5x | 0.5x |
氨气的体积分数= ![]() =20%;解得:x=37.5mol,
=20%;解得:x=37.5mol,
氨气的平衡转化率= ![]() ×100%=75%,所以答案是:>;75%;
×100%=75%,所以答案是:>;75%;
(2.)①根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡逆向移动,正反应反应是放热反应,故△H<0;
反应物是气体,产物是固体,该反应是熵减小的过程,即,△S<0,
所以答案是:A;
②A.因为氨基甲酸铵为固体,分离出少量的氨基甲酸铵,平衡不移动,所以反应物的转化率不变,故A错误;
B.平衡时降低体系温度,平衡向放热方向即正反应方向移动,又氨基甲酸铵为固体,所以NH3和CO2始终为2:1,则CO2的体积分数不变,故B错误;
C.因为体积比为2:1的NH3和CO2混合气体充入反应,NH3和CO2又按照2:1的消耗,所以NH3的转化率始终等于CO2的转化率,故C正确;
D.催化剂只改变速率,不改变平衡移动,所以加入有效的催化剂不能够提高氨基甲酸铵的产率,故D错误;
所以答案是:C;
③因为氨基甲酸铵极易水解成碳酸铵,即反应式为NH2COONH4(s)+H2O(NH4)2CO3 , 加入1L0.1mol/L的盐酸溶液中直到溶液pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH﹣、Cl﹣ , 根据电荷守恒c(NH4+)=c(Cl﹣)=0.1mol/L,又用去0.052mol氨基甲酸铵,所以开始溶液中的铵根离子浓度为0.052mol/L×2=0.104mol/L,
NH4+ | + | H2O | NH3H2O | + | H+ | ||
开始 | 0.104mol/L | 0 | |||||
转化 | 0.004mol/L | 0.004mol/L | |||||
平衡 | 0.1mol/L | 0.004mol/L |
又溶液为pH=7,所以氢离子浓度为10﹣7mol/L,则NH4+水解平衡常数K= ![]() =
= ![]() =4×10﹣9 ,
=4×10﹣9 ,
所以答案是:0.1mol/L;4×10﹣9;
(3.)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳,则负极反应为:CO(NH2)2+H2O﹣6e﹣═N2↑+CO2↑+6H+ , 所以答案是:CO(NH2)2+H2O﹣6e﹣═N2↑+CO2↑+6H+ .
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热,以及对化学平衡状态的判断的理解,了解状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.


科目:高中化学 来源: 题型:
【题目】下列各种物质中,所含化学键类型完全相同,晶体类型也完全相同的是( )
A.CO2、H2OB.NaOH、Na2OC.NaCl、HClD.SO2、SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将600mL稀硫酸等体积分为6份,并向其中5份中分别加入质量不等的Zn粒,并收集生成的氢气,有以下记录结果。(氢气的体积已折算为标准状况)
实验① | 实验② | 实验③ | 实验④ | 实验⑤ | |
Zn质量(g) | 5.0 | 8.0 | 12 | 14 | 16 |
H2体积(L) | 1.72 | 4.14 | 4.48 | 4.48 |
(1)由实验结果可推知,此稀硫酸的物质的量浓度为____________。
(2)实验②收集到H2的体积为____________。
(3)若向第6份稀硫酸中不断加入Zn粒,请在下图中画出H2体积(V)与Zn粒质量(m)的关系图像____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物在酸性催化条件下发生水解反应,生成两种不同的有机物,且这两种有机物的相对分子质量相等,该有机物是①蔗糖 ②麦芽糖 ③丙酸丙酯 ④甲酸乙酯( )
A.①②④
B.①
C.③
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)常温下某溶液中由水电离出的离子浓度符合c(H+)c(OH﹣)=1×10﹣20的溶液,其pH为 , 此时水的电离受到
(2)在某温度下,H2O的离子积常数为1×10﹣13 mol2L﹣2 , 则该温度下:100mL 0.1molL﹣1H2SO4溶液与100mL 0.4molL﹣1的KOH溶液混合后,pH= .
(3)已知一溶液有4种离子:X+、Y﹣、H+、OH﹣ , 下列分析结果肯定错误的是
A.c(Y﹣)>c(X+)>c(H+)>c(OH﹣)
B.c(X+)>c(Y﹣)>c(OH﹣)>c(H+)
C.c(H+)>c(Y﹣)>c(X+)>c(OH﹣)
D.c(OH﹣)>c(X+)>c(H+)>c(Y﹣)
(4)在25℃下,将a molL﹣1的氨水与0.01molL﹣1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl﹣).则溶液显(填“酸”“碱”或“中”)性;用含a的代数式表示NH3H2O的电离常数Kb= .
(5)水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值:
HClO:Ka=3×10﹣8 H2CO3:Ka1=4.3×10﹣7 Ka2=5.6×10﹣11;84消毒液中通入少量的CO2 , 该反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
(1)有科学家提出可利用FeO吸收和利用CO2 , 相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=﹣76.0kJmol一1
上述反应中每生成1mol Fe3O4 , 转移电子的物质的量为mol.
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2 (g) C H4 (g)+2H2O(g),向一容积为2L的恒容密闭容器中充人一定量的CO2和H2 , 在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2molL一1 , H2 0.8molL一1 , CH40.8molL一1 , H2O1.6molL一1 . 则CO2的平衡转化率为300℃时上述反应的平衡常数K= . 200℃时该反应的平衡常数K=64.8,则该反应的△H(填“>’’或“<”)O.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往1.0molL﹣1KI溶液中加入固体I2 , 发生反应:I2(aq)+I﹣ (aq)═I3﹣(aq)△H;I﹣的物质的量浓度c(I﹣)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( ) 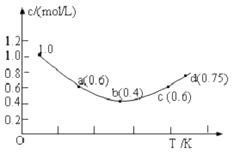
A.该反应的△H>0
B.a、c两点对应的I﹣反应速率相等
C.b点时0~10s I﹣的平均反应速率为0.04molL﹣1s﹣1
D.d点时该反应在对应温度下处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质一定属于同系物的是( )
① ![]() ②
② ![]() ③
③ ![]() ④C2H4 ⑤CH2=CH﹣CH=CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2=CH﹣CH=CH2 ⑥C3H6 ⑦ ![]() ⑧
⑧ ![]()
A.①和②
B.④和⑥
C.①和③
D.④和⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com