


科目:高中化学 来源: 题型:
| A、乙烯的结构简式为C2H4 |
| B、质子数为53,中子数为78的碘原子:53131I |
C、S2-的结构示意图: |
D、NH4Cl的电子式为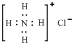 |
查看答案和解析>>
科目:高中化学 来源: 题型:
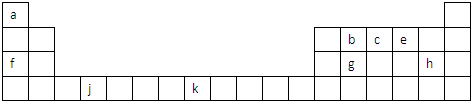
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图.下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图.下列说法正确的是( )| A、元素Y与元素Z的最高正化合价之和的数值等于9 |
| B、离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| C、原子半径的大小顺序为:rZ>rW>rQ>rX>rY |
| D、元素W的氢化物稳定性和还原性均比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
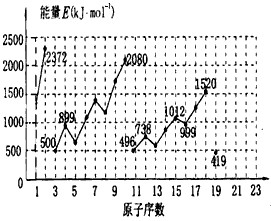
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(NH3?H2O) |
| c(NH | + 4 |
| c(SO | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
| c(CO2)(mol?L-1) | 1 | 0.85 | 0.5 | 0.5 | 0.6 | 0.6 |
| c(H2)(mol?L-1) | 1 | 0.85 | 0.5 | 0.5 | 0.6 | 0.6 |
| c(CO)(mol?L-1) | 0 | 0.15 | 0.5 | 0.5 | 0.9 | 0.9 |
| c(H2O)(mol?L-1) | 0 | 0.15 | 0.5 | 0.5 | 0.4 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com