
(15分)某兴趣小组用下图装置探究氨的催化氧化。(三氧化二铬作催化剂)
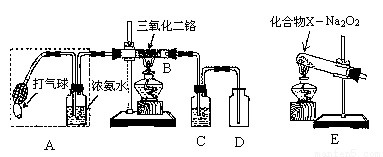
(1)氨催化氧化的化学方程式为 _________________________________________。
(2)加热玻璃管B一段时间后,挤压A中打气球鼓入空气,观察到B中物质呈红热状态;停止加热后仍能保持红热,该反应是_______反应(填“吸热”或“放热”)。
(3)为保证在装置D中观察到红棕色气体,装置C应装入_____________;若取消C,在D中仅观察到大量白烟,原因是_________________________。
(4)为实现氨催化氧化,也可用装置E替换装置_____________(填装置代号);化合物X为___________(填化学式只写一种),Na2O2的作用是__________________。
(共15分)
(1)4NH3 + 5O2 4NO + 6H2O (3分)(2) 放热(2分)
4NO + 6H2O (3分)(2) 放热(2分)
(3)浓H2SO4 (2分); 生成的NO与O2反应生成NO2 ,NO2与水反应生成HNO3 ,NH3与HNO3反应生成了NH4NO3(2分)
(4)A(2分);NH4Cl(2分);与HCl反应生成氧气(2分)(合理答案均给分)
【解析】
试题分析:(1)氨气具有还原性,在催化剂作用下可与氧气反应被氧化为NO,化学方程式为4NH3+5O2 4NO+6H2O
4NO+6H2O
(2)停止加热后仍能保持红热,即可说明该反应放热。
(3)NO2易与水反应,应干燥,所以装置C应装入:浓硫酸;如不干燥,NO2与水反应生成硝酸而观察不 到颜色,NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3,可观察到白烟生成。
(4)装置A能提供氨气和氧气,装置E也能提供氨气和氧气,所以可用装置E替换装置A;装置5中应加入氯化铵和过氧化钠,所以化合物X为:NH4Cl;发生反应的化学方程式为:NH4Cl HCl+NH3,HCl+Na2O2═2NaCl+O2+H2O,所以Na2O2的作用是:与HCl反应生成氧气。
HCl+NH3,HCl+Na2O2═2NaCl+O2+H2O,所以Na2O2的作用是:与HCl反应生成氧气。
考点:本题考查实验方案的设计与分析、氨气的制取和性质、化学方程式的书写。


科目:高中化学 来源:2015届福建省四地六校高三上学期第一次月考化学试卷(解析版) 题型:填空题
(16分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
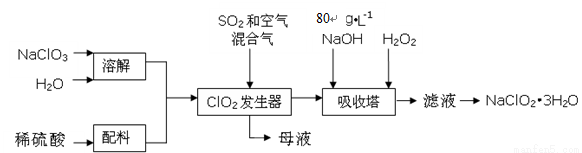
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③80 g·L-1 NaOH溶液是指80 g NaOH固体溶于水所得溶液的体积为1L。
(1)80 g·L-1 NaOH溶液的物质的量浓度为 ;
(2)发生器中鼓入空气的作用可能是 (选填序号);
a.将SO2氧化成SO3,增强酸性 b.将NaClO3氧化成ClO2 c.稀释ClO2以防止爆炸
(3)从“母液”中可回收的主要物质是 ;
(4)吸收塔内的反应的化学方程式为 ;
吸收塔的温度不能超过20℃,其目的是 ;
(5)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 ;
(6)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号);
a.Na2S b.Na2O2 c.FeCl2
(7) 从吸收塔出来的溶液中得到NaClO2?3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸发浓缩 b.蒸馏 c.过滤 d.灼烧 e.冷却结晶
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期半期联考化学试卷(解析版) 题型:实验题
(14分)某实验小组用0.50mol/L氢氧化钠溶液和0.50mol/L硫酸溶液进行反应热的测定。
Ⅰ.配制0.50mol/L氢氧化钠溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体_________克。
(2)配制过程中,所需要的玻璃仪器有_____________________________________
Ⅱ.测定稀硫酸和稀氢氧化钠溶液反应的反应热实验装置如下:
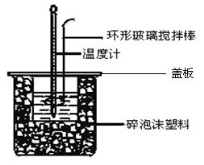
(3)如图装置中仪器环形玻璃搅拌棒作用是___________________________________;
(4)烧杯间填满碎泡沫塑料、大烧杯上加盖硬纸板的作用是__________________
(5)已知稀硫酸与稀氢氧化钠溶液发生中和反应生成1 mol水时,放出57.3 KJ热量。请写出硫酸与氢氧化钠发生中和反应的热化学方程式:__________________________________________,用0.2 mol 稀硫酸溶液与足量稀氢氧化钠溶液反应,能放出________kJ热量。
(6)在测定中和反应的反应热的实验中,下列叙述正确的是
A.测定中和反应的反应热时,酸碱中和之后应读取体系达到的最高温度
B.中和反应的试验中,应快速将NaOH溶液一次倒入盛盐酸的小烧杯中
C.可以用氢氧化钾代替氢氧化钠,浓硫酸代替稀硫酸
D.在测定中和反应的反应热实验中,每完成一次反应热热测定,至少需要读三次温度
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期半期联考化学试卷(解析版) 题型:选择题
在一定条件下,密闭容器中发生可逆反应2X(g)+2Y(g)  3Z(g)+2W(g),该X、Y的初始浓度分别为2.5 mol·L-1和2.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是
3Z(g)+2W(g),该X、Y的初始浓度分别为2.5 mol·L-1和2.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是
A.c(Z)=1.5 mol·L-1 B.c(Z)=2.4 mol·L-1
C.c(W)=1.6 mol·L-1 D.c(W)=2.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期半期联考化学试卷(解析版) 题型:选择题
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A.2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
B.2SO2(g)+O2(g) 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+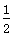 O2(g)
O2(g) SO3(g) ΔH=+98.3 kJ·mol-1
SO3(g) ΔH=+98.3 kJ·mol-1
D.SO2(g)+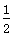 O2(g)
O2(g) SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期半期联考化学试卷(解析版) 题型:选择题
某同学研究铝及其化合物的性质时设计了如下两个实验方案。
方案一:
方案二:
已知:NaOH溶液和稀盐酸的浓度均是3 mol·L-1,如图是向X溶液和Y溶液中分别加入NaOH溶液和稀盐酸时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是

A.在O点时两方案中所得溶液的溶质物质的量相等
B.b曲线表示的是向X溶液中加入NaOH溶液
C.X溶液溶质为AlCl3,Y溶液溶质为NaAlO2
D.a、b曲线表示的反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期半期联考化学试卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:
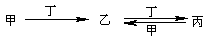
下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2
B.若甲为氮气,则丁可能是O2
C.若甲为Fe,则丁可能是稀硝酸
D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源:2015届福建省高一上学期半期联考化学试卷(解析版) 题型:选择题
某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子,其物质的量浓度比为c(Na+)∶c(Mg2+)∶c(Cl-)=3∶4∶5,若Na+的物质的量浓度为3 mol·L-1,则SO42-的物质的量浓度为
A.2 mol·L-1 B.3 mol·L-1
C.4 mol·L-1 D.8 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三9月月考化学试卷(解析版) 题型:选择题
有机物X、Y、M的转化关系为: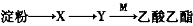 ,下列说法错误的是( )
,下列说法错误的是( )
A.X可用新制的氢氧化铜检验 B.Y有同分异构体
C.M含有两种碳氧共价键 D.Y可发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com