
| A. | A、B、C最简单氢化物的沸点依次递减,是因为A、B、C非金属性依次递减 | |
| B. | EB晶体是一种坚硬的高熔点材料,熔化时需克服离子键 | |
| C. | 在一定条件下,B的氧化物与B的简单氢化物均能反应生成单质B | |
| D. | C、D的常见氧化物均能溶于氢氧化钠溶液中,则C、D的氧化物均属于酸性氧化物 |
分析 A、B、C、D均为短周期元素,且原子半径依次增大,由C的单质是一种半导体材料,则C为Si;A的最外层电子数是次外层的3倍,则A为第二周期的O元素,A与B同周期且相邻,可知B为N;A2-与D3+具有相同的电子层结构,则D为Al;D和E同主族,A与E元素原子的电子层数相差2,则E为第四周期的Ga元素,然后结合元素周期律及元素化合物知识来解答.
解答 解:A、B、C、D均为短周期元素,且原子半径依次增大,由C的单质是一种半导体材料,则C为Si;A的最外层电子数是次外层的3倍,则A为第二周期的O元素,A与B同周期且相邻,可知B为N;A2-与D3+具有相同的电子层结构,则D为Al;D和E同主族,A与E元素原子的电子层数相差2,则E为第四周期的Ga元素,
A.A为O,B为N,C为Si,含氢键的沸点高,A、B、C最简单氢化物的沸点依次递减,与氢键有关,而非金属性递减无关,故A错误;
B.E为Ga,B为N,二者形成的晶体熔化需克服离子键,但不是坚硬的高熔点材料,故B错误;
C.由氧化还原反应及化合价变化的规律可知,在一定条件下,N的氧化物与B的简单氢化物氨气均能反应生成单质B,故C正确;
D.C、D的常见氧化物均能溶于氢氧化钠溶液中,但C的氧化物为酸性氧化物,而D的氧化物(氧化铝)属于两性氧化物,故D错误;
故选C.
点评 本题考查位置、结构、性质的关系,为高频考点,把握元素化合物性质、原子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:推断题
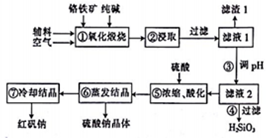 红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,在印染、电镀等行业应用十分广泛.工业上以铬铁矿(主要成分为FeO•Cr2O3,还含少量SiO2)为原料制取红矾钠的流程如图所示.
红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,在印染、电镀等行业应用十分广泛.工业上以铬铁矿(主要成分为FeO•Cr2O3,还含少量SiO2)为原料制取红矾钠的流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$$\stackrel{滴加硝酸钡溶液}{→}$白色沉淀$\stackrel{滴加稀盐酸}{→}$沉淀不溶解→说明试样已变质 | |
| B. | 检验某溶液中是否含有Fe2+:试样$\stackrel{滴加硫氰化钾}{→}$溶液颜色无变化$\stackrel{滴加氯水}{→}$溶液变红色→溶液中含有Fe2+ | |
| C. | 除去粗盐中含有的硫酸钙杂质:粗盐$\stackrel{溶解}{→}$$\stackrel{足量硝酸钠溶液}{→}$$\stackrel{足量氯化钡溶液}{→}$$\stackrel{过滤}{→}$$\stackrel{滤液中滴加盐酸}{→}$$\stackrel{蒸发结晶}{→}$精盐 | |
| D. | 证明酸性条件H2O2的氧化性比I2强:NaI溶液$\stackrel{30%过氧化氢、稀硝酸}{→}$$\stackrel{淀粉}{→}$溶液变紫色→氧化性:H2O2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学生欲通过实验方法验证 Fe2+的性质.
某学生欲通过实验方法验证 Fe2+的性质.| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红综色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+═Fe3++NO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
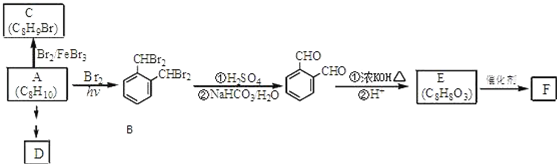
 ;
; ;
; ;
; .(提示
.(提示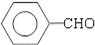 $\underset{\stackrel{①浓KOH、△}{→}}{②{H}^{+}}$
$\underset{\stackrel{①浓KOH、△}{→}}{②{H}^{+}}$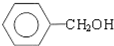 +
+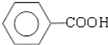 )
)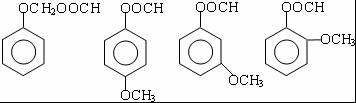 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 126C、136C、146C三种核素互为同素异形体 | |
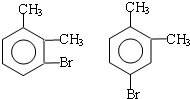
| B. | 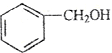 和 和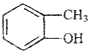 的分子式相同,化学性质也相同 的分子式相同,化学性质也相同 | |
| C. | 等质量的甲烷按a,b两种途径完全转化,途径a比途径b消耗更多的O2 途径a:CH$→_{催化剂}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O;途径b:CH4$→_{燃烧}^{O_{2}}$CO2+H2O | |
| D. | 铝热反应实验说明:在一定条件下铝的还原性强于很多难熔金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
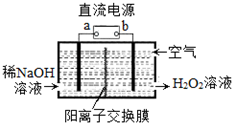 H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )
H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )| A. | a为负极 | |
| B. | 通入空气的电极反应式为O2+2e-+2H+═H2O2 | |
| C. | 电解一段时间后,左侧溶液pH降低 | |
| D. | 若生成17g双氧水,则有1molH+从左侧向右侧迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
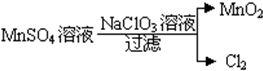
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com