
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
( )
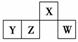
A.原子半径:rW>rZ>rY>rX
B.含Y元素的盐溶液有的显酸性,有的显碱性
C.气态氢化物的热稳定性:Z>W
D.X与H、O元素形成的化合物一定是共价化合物
科目:高中化学 来源: 题型:
电子表所用纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液。其电极反应是:
Zn+2OH-—→ZnO+H2O+2e-
Ag2O+H2O+2e-—→2Ag+2OH-
总反应式为:Ag2O+Zn===2Ag+ZnO
下列判断正确的是( )
①锌为正极,Ag2O为负极
②锌为负极,Ag2O为正极
③原电池工作时,负极区溶液pH减小
④原电池工作时,负极区溶液pH增大
A.①② B.①③ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是( )
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25 mL 0.1 mol·L-1的盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液由Na+、Ag+、Ba2+、Al3+、
[Al(OH)4]-、MnO4-、CO32-、SO42-中的若干种组成。取该溶液进行如下实验:
(A)取试液适量,加入过量稀盐酸,有气体生成,得到溶液甲
(B)向溶液甲中再加入过量碳酸氢铵溶液,有气体生成,析出白色沉淀乙,得到溶液丙
(C)向溶液丙中加入过量Ba(OH)2溶液,有气体生成,析出白色沉淀丁。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是________________________________________。
(2)一定存在的离子是________________________________________________。
(3)生成沉淀乙的离子反应方程式是____________________________________。
(4)写出步骤(C)中产生气体的离子方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示。下列说法正确的是( )
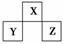
A.原子半径:Z>Y>X
B.若Y的氧化物为两性氧化物,则Z的一种单质在空气中易自燃
C.若X的气态氢化物与Z的最高价氧化物的水化物能反应,则生成的盐仅有一种
D.若Y与Z的核电荷数之和为X的4倍,则X、Z的气态氢化物的沸点前者低于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是(双选)( )
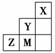
A.离子半径:M->Z2->Y-
B.Z元素形成的氧化物都是共价化合物
C.气态氢化物稳定性,Y>Z>M
D.三种元素中,M的最高价氧化物对应的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)1/2N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
利用绿色化学原理,用甲烷合成乙酸乙酯,欲使原子利用率最大,还需消耗的其他反应物有( )
|
| A. | CO | B. | CO2和H2O | C. | H2O与O2 | D. | CH3OH与O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com