
 下列有关说法正确的是( )
下列有关说法正确的是( )| A. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)将减小 | |
| B. | 一定温度下,反应“2HI(g)=H2(g)+I2(g)△H>0”能自发进行,则该反应△S>0 | |
| C. | 向滴有酚酞的Na2CO3溶液中滴加BaCl2溶液,红色逐渐褪去,说明BaCl2溶液显酸性 | |
| D. | 如图电池放电时的正极反应式:2Li++Li2O2+2e-=2Li2O |
分析 A、NH4+结合OH-使氢氧化镁溶解平衡正向移动;
B、△H-T△S<0的反应能够自发进行;
C、Na2CO3溶液显碱性是因为碳酸根离子的水解,Na2CO3+BaCl2=BaCO3↓+2NaCl,导致碳酸根离子浓度减小;
D、原电池的正极反应还原反应.
解答 解:A、Mg(OH)2的悬浊液中存在溶解平衡,氢氧根离子浓度减小,平衡正向移动,c(Mg2+)将增大,故A错误;
B、该反应的△H>0,反应能够自发进行,说明△H-T△S<0,所以必须△S>0,故B正确;
C、碳酸根离子浓度减小最后消失,没有水解的离子,溶液碱性消失,故C错误;
D、该原电池的负极反应式为2Li-2e-=2Li+,正极反应式为2Li++Li2O2+2e-=2Li2O,故D正确;
故选BD.
点评 本题考查了沉淀的溶解平衡、反应自发进行的条件、盐类水解、电极反应式书写,题目难度不大.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 6.4g由S2、S4、S8组成的混合物中所含硫原子数为0.2NA | |
| B. | 用100ml 4mol/L盐酸与8.7g MnO2供热能制取氯气4.48L | |
| C. | 一定温度下,0.1L 0.1mol/L的CH3COOH溶液和1L 0.01mol/L 的CH3COOH溶液所含CH3COO-的数目均为0.01NA | |
| D. | 一定条件下,将1mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
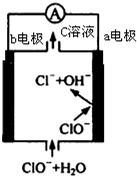 镁-次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有关说法正确的是( )
镁-次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有关说法正确的是( )| A. | 电池工作时,C溶液中的溶质是MgCl2 | |
| B. | 电池工作时,正极a附近的PH将不断增大 | |
| C. | 负极反应式:ClO --2e -+H2O═Cl-+2 OH- | |
| D. | b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN- | |
| B. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=106的溶液中:NH4+、K+、AlO2-、NO3- | |
| C. | 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl- | |
| D. | 1.0 mol•L-1的KNO3溶液中:Fe2+、H+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |
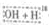 OCH2CH3$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O
OCH2CH3$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O
 后消去失水,失水有两种可能分别生成
后消去失水,失水有两种可能分别生成 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )
科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )| A. | 羟基硝酸铵中阳离子的各原子共平面 | |
| B. | 羟基硝酸铵是离子化合物 | |
| C. | 羟基硝酸铵中含有离子键和共价键 | |
| D. | 9.6g羟基硝酸铵中含有0.2mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C12H20O2 | |
| B. | 能发生加成反应、取代反应、氧化反应 | |
| C. | 1mol该有机物在一定条件下能和3mol H2发生反应 | |
| D. | 该有机物仅含有两种不同类型的官能团 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com