
某兴趣小组为探究外界条件对可逆反应A(g)+B(g)  C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
| A | B | C |
Ⅰ | 0.050 mol·L-1 | 0.050 mol·L-1 | 0.050 mol·L-1 |
Ⅱ | 0.070 mol·L-1 | 0.070 mol·L-1 | 0.098 mol·L-1 |
Ⅲ | 0.060 mol·L-1 | 0.060 mol·L-1 | 0.040 mol·L-1 |
Ⅳ | 0.080 mol·L-1 | 0.080 mol·L-1 | 0.12 mol·L-1 |
针对上述系列试验,下列结论中错误的是( )
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20 mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与I比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,通过压缩容器的体积就可以实现
科目:高中化学 来源:2015届吉林省高二3月月考化学试卷(解析版) 题型:选择题
在实验室中进行下列实验,括号内的实验用品都能用到的是
A.硫酸铜晶体里结晶水含量的测定(坩埚、温度计、硫酸铜晶体)
B.蛋白质的盐析(试管、醋酸铅溶液、鸡蛋白溶液)
C.钠的焰色反应(铂丝、氯化钠溶液、稀盐酸)
D.肥皂的制取(蒸发皿、玻璃棒、甘油)
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题9有机化合物的获取与应用练习卷(解析版) 题型:选择题
下列关于糖类的说法中正确的是( )
A.糖类都能发生水解反应
B.单糖都能发生银镜反应
C.葡萄糖与果糖是同分异构体,淀粉与纤维素也是同分异构体
D.单糖都能发生酯化反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷(解析版) 题型:填空题
醋酸是重要的一元酸,在有机和无机反应中都有应用。
(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下表:
反应 | 乙醇(mol) | 乙酸(mol) | 乙酸乙酯(mol) |
1 | 2 | 2 | 1.33 |
2 | 3 | 2 | 1.57 |
3 | 4 | 2 | x |
4 | 5 | 2 | 1.76 |
由表中数据推测,数值x的范围是________。
(2)现有25°C时,pH=3的醋酸。请回答以下问题:
①若向醋酸中加入少量醋酸钠固体,此时溶液中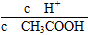 将________(填“增大”“减小”或“不变”);
将________(填“增大”“减小”或“不变”);
②若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH________7(填“>”“<”或“=”);
③若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷(解析版) 题型:选择题
下图是向100 mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图像,根据如图所得结论正确的是( )
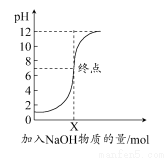
A.原来盐酸的物质的量浓度为0.1 mol·L-1
B.NaOH溶液的浓度为0.1 mol·L-1
C.原来盐酸的物质的量浓度为1 mol·L-1
D.NaOH溶液的浓度为0.01 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:填空题
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g) 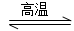 Si3N4(s)+12HCl(g) ΔH<0
Si3N4(s)+12HCl(g) ΔH<0
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率为________mol/(L·min);该反应的平衡常数表达式K=________。
(2)上述反应达到平衡后,下列说法正确的是________。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(3)一定条件下,在密闭恒容的容器中, 能表示上述反应达到化学平衡状态的是________。
a.3v逆(N2)=v正(H2)
b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变
d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为m/n,保持其他条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比________m/n(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:选择题
将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)  2NH3(g)+CO2(g),在不同温度下,该反应平衡状态时的部分数据见下表。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应平衡状态时的部分数据见下表。下列说法正确的是( )
温度 | 平衡浓度/(mol·L-1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 |
|
T2 |
| 0.1 |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,H2NCOONH4转化的Δn(T2)=2Δn(T1)
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:填空题
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2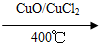 2Cl2+2H2O
2Cl2+2H2O
(1)已知:ⅰ.反应A中,4 molHCl被氧化,放出115.6 kJ的热量。
ⅱ.
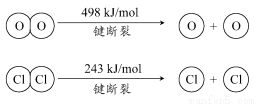
①H2O的电子式是________。
②反应A的热化学方程式是______________________________________。
③断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”)________。
(2)对于反应A,下图是在4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
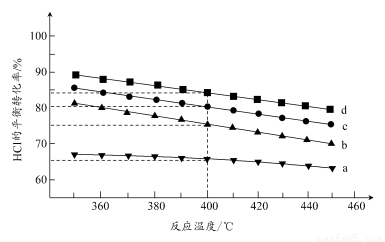
①曲线b对应的投料比是________。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是______________________________。
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷(解析版) 题型:填空题
日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下:
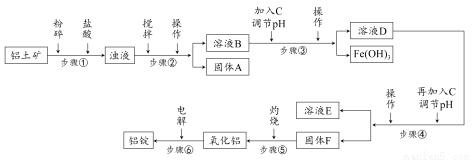
一些氢氧化物沉淀的pH如下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
开始沉淀pH(离子初始浓度0.01 mol/L) | 4 | 2.3 | 10.4 |
完全沉淀pH(离子浓度<10-5 mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为________________。
(2)实验室进行步骤②③④的操作名称为________。
(3)固体A的化学式为________,物质C的化学式为________;溶液中的Na+、Ca2+、Mg2+是在步骤________中分离出去的。
(4)步骤③调节pH的数值范围为________,步骤④调节pH的数值范围为________。
(5)步骤⑥反应的化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com