



科目:高中化学 来源:不详 题型:填空题
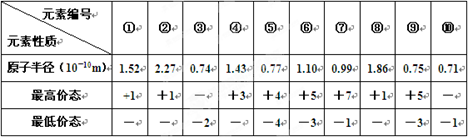
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化铯晶体中,每个Cs+周围紧邻8个Cl- |
| B.氯化钠晶体中,每个Na+周围距离最近且相等的Na+共有6个 |
| C.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
| D.金刚石为网状结构,由共价键形成的碳原子环中,最小环上有6个碳原子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属的导电性、导热性、延展性都与自由电子有关 |
| B.六方最密和面心立方最密的原子堆积方式空间利用率最高 |
C.钠晶胞结构如下图,钠晶胞中每个钠原子的配位数为6 |
| D.温度升高,金属的导电性将变小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
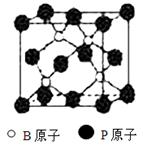
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
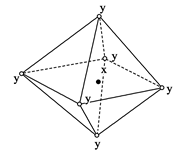
| A.NaCl(x=Na+,y=Cl-) |
| B.CsCl(x=Cs+,y=Cl-) |
| C.金属钋(Po) |
| D.MgO晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
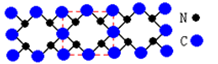
| A.氮化碳晶体属于原子晶体 |
| B.氮化碳中碳显—4价,氮显+3价 |
| C.氮化碳的化学式为C3N4 |
| D.每个碳原子与三个氮原子相连,每个氮原子与四个碳原子相连 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
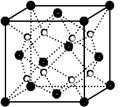
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com