
【题目】下列离子方程式表示的是盐类的水解且正确的是( )
A. HS-+H2O![]() H3O++S2-
H3O++S2-
B. HS-+H+===H2S
C. CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
科目:高中化学 来源: 题型:
【题目】根据反应Br+H2![]() HBr+H的能量随反应历程的变化示意图甲进行判断,下列叙述中不正确的是
HBr+H的能量随反应历程的变化示意图甲进行判断,下列叙述中不正确的是
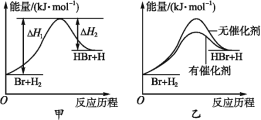
A. 正反应吸热
B. 加入催化剂,该化学反应的反应热不变
C. 加入催化剂后,该反应的能量随反应历程的变化示意图可用图乙表示
D. 加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年新春之际,出现了罕见的新型冠状病毒肺炎,威胁着人们的身体健康。以下消毒剂可以有效地灭活病毒,走进了百姓的生活中。下列叙述中,不正确的是
A.高锰酸钾(KMnO4)是电解质
B.H2O2分子中所有原子都达到了8电子结构
C.次氯酸钠(NaClO)是离子化合物
D.医用酒精是体积分数为75%的乙醇溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定的温度下,将2mol A和3mol B充入一密闭容器中发生如下反应:aA(g)+B(g)![]() C(g)+D(g),5 min后达到平衡。已知该温度下反应的平衡常数K=1,在t0时刻,若保持温度不变将容器的体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
C(g)+D(g),5 min后达到平衡。已知该温度下反应的平衡常数K=1,在t0时刻,若保持温度不变将容器的体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )

A. 正反应是一个体积减小的反应,a=2
B. 速率随时间的变化关系可用上图表示
C. 达平衡时B的转化率为40%
D. 为提高A的转化率,可采取升高温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格列卫是治疗白血病和多种癌症的一种抗癌药物,在其合成过程中的一种中间产物结构表示如下:

下列有关该中间产物的说法不正确的是
A. 分子中可以发生水解反应的官能团有两种
B. 碱性条件下水解的产物之一,含有官能团—NH2
C. 碱性条件下水解的产物之一,经酸化后自身可以发生缩聚反应
D. 水解产物的单个分子中,苯环上都有3种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A. 检验溴乙烷消去反应产物
B. 证明Fe(OH)3比Mg(OH)2更难溶
C. 检验蔗糖的水解产物
D. 探究铁的析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下图,下列叙述正确的是

A. 若该图表示的是活细胞的各化学元素的含量,则甲为碳元素
B. 若该图表示的是细胞各化学元素占干重的百分比,则甲为氧元素
C. 若该图为活细胞的化合物组成情况,则甲中含有的元素为C、H、0
D. 若该图是完全脱水后的细胞的化合物组成情况,则甲是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将生物质气(主要成分为CO、CO2和H2)甲烷化是改善燃气质量、改善燃气热值的有效手段之一。在催化剂的作用下,某密闭容器中,进行生物质气甲烷化时发生的主要反应为
①CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H1;
CH4(g)+H2O(g) △H1;
②CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H2=-165.1kJ·mol-1;
CH4(g)+2H2O(g) △H2=-165.1kJ·mol-1;
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2kJ·mol-1。
CO2(g)+H2(g) △H3=-41.2kJ·mol-1。
请回答下列问题:
(1)△H1=___________,该反应在___________(填“高温”或“低温”)条件下能够自发进行。
(2)在合成气投料比保持恒定时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示。α(CO)随温度升高而减小的原因是______________________。图中的压强由大到小的顺序为___________。

(3)温度为T1℃,在三个容积均为1L的恒容密闭容器中仅发生反应CO(g)+3H2(g)![]() CH4(g)+H2O(g),该反应中,正反应速率为v正=k正c(CO)c3(H2),逆反应速率为v逆=k逆c(CH4)·c(H2O),k正、k逆为速率常数,受温度影响。在第I个容器中,3min反应达到平衡时,CH4与CO的体积分数相同,则氢气的速率v(H2)=___________;下列说法正确的是___________(填序号)。
CH4(g)+H2O(g),该反应中,正反应速率为v正=k正c(CO)c3(H2),逆反应速率为v逆=k逆c(CH4)·c(H2O),k正、k逆为速率常数,受温度影响。在第I个容器中,3min反应达到平衡时,CH4与CO的体积分数相同,则氢气的速率v(H2)=___________;下列说法正确的是___________(填序号)。

A.当温度改变为T2时,若k正=1.5k逆,则T2>T1
B.达平衡时,容器Ⅱ中H2的体积分数小于25%
C.达平衡时,容器Ⅲ与容器I中的总压强之比小于19︰20
D.达平衡时,容器Ⅱ中α(CO)大于容器I中α(CO)
(4)甲烷可作燃料电池的原料,若电解质为盐酸,当外电路转移16mol电子时(不考虑电子的损失),将负极产生的气体全部通入到2L1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com