
分析 1273k时,在固定体积为2L的密闭容器中加入2mol一氧化碳和2mol水,达到平衡状态时测得H2浓度为0.5mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol/L):1 1 0 0
变化浓度(mol/L):0.5 0.5 0.5 0.5
平衡浓度(mol/L):0.5 0.5 0.5 0.5
(1)根据K=$\frac{c(CO)×c({H}_{2})}{c(CO)×c({H}_{2}O)}$计算平衡常数;
(2)转化率=$\frac{浓度变化量}{起始浓度}$×100%;
(3)设需要加入xmol才能使CO平衡转化率达到90%,则转化的CO为1.8mol,表示出平衡时各组分的物质的量,再根据平衡常数列方程计算.
解答 解:1273k时,在固定体积为2L的密闭容器中加入2mol一氧化碳和2mol水,达到平衡状态时测得H2浓度为0.5mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol/L):1 1 0 0
变化浓度(mol/L):0.5 0.5 0.5 0.5
平衡浓度(mol/L):0.5 0.5 0.5 0.5
(1)平衡常数K=$\frac{c(CO)×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.5×0.5}{0.5×0.5}$=1,
答:该温度下平衡常数K=1;
(2)平衡时CO转化率=$\frac{0.5mol/L}{1mol/L}$×100%=50%,
答:平衡时CO的转化率为50%;
(3)设需要加入xmol才能使CO平衡转化率达到90%,则转化的CO为2mol×90%=1.8mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol):2 2+x 0 0
变化(mol):1.8 1.8 1.8 1.8
平衡(mol):0.2 0.2+x 1.8 1.8
反应前后气体体积不变,可以用物质的量代替浓度计算平衡常数,则$\frac{1.8×1.8}{0.2×(0.2+x)}$=1,解得x=16,
答:向该容器中再充入16mol水才能使CO平衡转化率达到90%.
点评 本题考查化学平衡计算,涉及平衡常数计算及应用,掌握化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品.其构想分成3个步骤:
有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品.其构想分成3个步骤:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
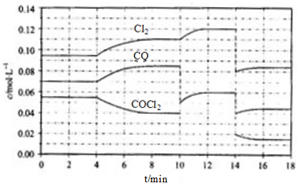 COCl2的分解反应为COCl2(g)?Cl2(g)+CO(g)△H=+108kJ•mol-1.反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图(第10min到14min的COCl2浓度变化曲线未示出):
COCl2的分解反应为COCl2(g)?Cl2(g)+CO(g)△H=+108kJ•mol-1.反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图(第10min到14min的COCl2浓度变化曲线未示出):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用物质A表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| B. | 用物质B表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| C. | 2 s 时物质A的转化率为70% | |
| D. | 2 s 时物质B的浓度为 0.7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com