
����Ŀ��W��X��Y��Z��M��RΪ6�ֶ�����Ԫ�ء�Wԭ�ӵĺ˵������������������X+��Ne������ͬ�ĵ��Ӳ�ṹ��Yԭ����Zԭ�ӵ�����������֮����Rԭ�ӵ�������������ȣ�Y��Z��M��R�����ڱ��е����λ����ͼ��ʾ��
Z | M | R | ||
Y |
��1��ZԪ�������ڱ���λ��Ϊ________��
��2��R���ӵĽṹʾ��ͼΪ_________��
��3��X��M��1:1�γɵĻ������д��ڵĻ�ѧ������Ϊ____________��
��4��Y�������������X������������ˮ������ˮ��Һ�з�����Ӧ�����ӷ���ʽΪ_________________________________��
��5��Y��Z �γ���Է�����Ϊ144�Ļ�������M�ļ��⻯�ﷴӦ�������������Y������������ˮ����÷�Ӧ�Ļ�ѧ����ʽΪ__________________________��
��6��M��R���γ�M2R2���ӣ��÷����и�ԭ�Ӿ��ﵽ8�����ȶ��ṹ����M2R2�ĵ���ʽΪ__________________��
���𰸡��ڶ�������A�� ![]() �Ǽ��Թ��ۼ������Ӽ� Al2O3+2OH=2AlO2+H2O Al4C3+12H2O=4Al(OH)3��+3CH4��
�Ǽ��Թ��ۼ������Ӽ� Al2O3+2OH=2AlO2+H2O Al4C3+12H2O=4Al(OH)3��+3CH4�� ![]()
��������
W��X��Y��Z��M��RΪ6�ֶ�����Ԫ�أ�Wԭ�ӵĺ˵��������������������WΪHԪ�أ�X+��Ne������ͬ�ĵ��Ӳ�ṹ����XΪNa����Y����������Ϊa����Z��Rԭ�������������ֱ�Ϊa+1��a+4����a+a+1=a+4�����a=3����YΪAl��ZΪC��MΪO��RΪF���ݴ˽��
(1)ZΪCԪ�أ�λ�����ڱ��ڶ�������A�壻
(2)R����ΪF�����ӵĽṹʾ��ͼΪ![]() ��
��
(3)XΪNa��MΪO��X��M��1:1�γɵĻ�����ΪNa2O2�����д��ڵĻ�ѧ���зǼ��Թ��ۼ������Ӽ���
(4)Y�����������ΪAl2O3��X������������ˮ����ΪNaOH�����߷�����Ӧ�����ӷ���ʽΪ��Al2O3+2OH=2AlO2+H2O��
(5) YΪAl��ZΪC��Y��Z �γ���Է�����Ϊ144�Ļ�����Ϊ��Al4C3��M�ļ��⻯��Ϊ��H2O��Al4C3��H2O��Ӧ���������CH4��Y������������ˮ����Al(OH)3������ʽΪ��Al4C3+12H2O=4Al(OH)3��+3CH4����
(6) M��R���γ�O2F2���÷����и�ԭ�Ӿ��ﵽ8�����ȶ��ṹ����ԭ��֮���γ�1�Թ��õ��Ӷԣ���ԭ�����ԭ��֮���γ�1�Թ��õ��Ӷԣ���O2F2�ĵ���ʽΪ![]() ��
��


 100�ִ�����ĩ���ϵ�д�
100�ִ�����ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. �Կ��淴ӦΪԭ����ԭ��ط�����Ӧ��ƽ��ʱ���õ�����е�������
B. ��AgCl��AgBr�ı�����Һ�м���������AgNO3����Һ�������Ӻ�������Ũ�ȵı�ֵ����
C. ʹ�ô����ܹ����ͷ�Ӧ�ġ�H
D. ��������������ʴʱ������ʴ����������Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л��������˵����ȷ����( )
A.��Ũ������Ҵ��ڼ����������Ʊ���ϩ��Ӧ��Ѹ�����µ�140��
B.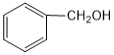 ��
�� 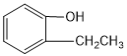 ��Ϊͬϵ��
��Ϊͬϵ��
C.�����������õķ���Һ���Ҵ�
D.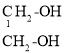 CH3CH2OH CH3CH2CH3���߷е㡢�ܽ�����ν���
CH3CH2OH CH3CH2CH3���߷е㡢�ܽ�����ν���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������غ������������Һ�ܷ���������ԭ��Ӧ��ClO3-+3HSO3-=3SO42-+ Cl-+3H+����֪�÷�Ӧ��������c(H+)��������ӿ졣��ͼΪ��ClO3-�ڵ�λʱ�������ʵ���Ũ�ȱ仯��ʾ�ĸ÷�Ӧv-tͼ������˵���в���ȷ���� ( )

A. ��Ӧ��ʼʱ�������������c(H+)����
B. ������Ϊv(Cl-)��v-t������ͼ��������ȫ�غ�
C. ͼ����Ӱ���ֵ������ʾt1��t2ʱ����ClO3-�����ʵ����ļ�����
D. ���ڷ�Ӧ�����½�����Ҫԭ���Ƿ�Ӧ��Ũ�ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������;�dz��㷺���ش��������⣺
��1����̬�ࣨSb��ԭ�Ӽ۵����Ų��Ĺ��ʽΪ____��[H2F]+[SbF6]���������ࣩ��һ�ֳ�ǿ�ᣬ����[H2F]+�������ӵĿռ乹��Ϊ______������д��һ����[H2F]+������ͬ�ռ乹�ͺͼ�����ʽ�ķ��Ӻ������ӷֱ���_______��_________��
��2�����ᣨH3BO3�����ķ�����泥�NH4BF4����������Ҫ�Ļ�����;��
��H3BO3��NH4BF4�漰������Ԫ���еڶ�����Ԫ�صĵ�һ�������ɴ�С��˳��_____����Ԫ�ط��ţ���
��H3BO3�������ܵ����H+����ˮ�����һ��OH������[B(OH)4]���������������ԡ�[B(OH)4]����Bԭ�ӵ��ӻ�����Ϊ_____��
��NH4BF4���ķ�����泥�����������ͭ�������ۼ����ܸ�ʴ�����ȡ��ķ�������д���_______������ţ���
A ���Ӽ� B �Ҽ� C �м� D ��λ�� E ���»���
��3��ij�����Ͻ�ľ�����ͼ��ʾ���谢���ӵ�������ֵΪ![]() ���þ�����ܶȦ�_________g��cm��3��
���þ�����ܶȦ�_________g��cm��3��
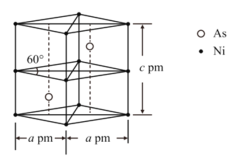 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ٴ�֤��������୶��������¹ڷ����������õ���Ч��������୵Ľṹ��ͼ��ʾ�������й�������୵�˵��������ǣ� ��
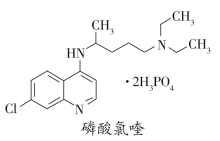
A.����ʽ��C18H32ClN3O8P2
B.�ܷ���ȡ�����ӳɺ���ȥ��Ӧ
C.1mol��������������5molH2�����ӳɷ�Ӧ
D.�����е���C1����OHȡ����IJ���������ˮ�������ɳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)pH��ȵ�NaOH��Һ��CH3COONa��Һ���ֱ���ȵ���ͬ���¶Ⱥ�CH3COONa��Һ��pH____NaOH��Һ��pH(����>������������<��)��
(2)�����ʵ���Ũ����ͬ�������백ˮ��Ϻ���Һ�е�c(NH4+)��c(Cl��)������������___��ˮ�����(����>������������<��)��
(3)��0.2 mol��L��1HA��Һ��0.1 mol��L��1NaOH��Һ��������(��Ϻ���Һ����仯���Բ���)����û����Һ��c(Na��)>c(A��)����
�������Һ�У�c(A��)________c(HA)(����>����<��������������ͬ)��
�������Һ�У�c(HA)��c(A��)________0.1 mol��L��1��
(4)����ʱ��ȡ0.1 mol��L��1HX��Һ��0.1 mol��L��1NaOH��Һ�������ϣ���û����Һ��pH��8��
�������Һ����ˮ�������c(OH��)��0.1 mol��L��1NaOH��Һ����ˮ�������c(OH��)֮��Ϊ________��
����֪NH4X��Һ�����ԣ���֪��HX��Һ���뵽Na2CO3��Һ��������ų������ƶ�(NH4)2CO3��Һ��pH____7(����>����<����������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ʱ����
ʱ����![]() ������Һ����μ���
������Һ����μ���![]() ��ˮ��������ͼ��ʾ������˵����ȷ����
��ˮ��������ͼ��ʾ������˵����ȷ����
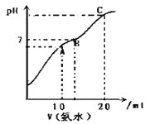
A.�˵ζ�ʵ�����ѡ�÷�̪��ָʾ��
B.��A�㣺 ![]()
C.��B�㣺 ![]()
D.��C�㣺 ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.10 mol/LKOH��Һ�ζ�10.00mL 0.10 mol/Lij��Ԫ����H2R��Һ���ζ�������ͼ�������Һ������������ǰ������Һ���֮�ͣ������й�ϵ��ȷ����
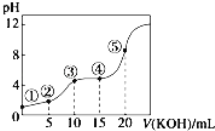
A. �����ʾ��Һ�У�c��K+��+c��H+��=c��HR����+c��R2����+c��OH����
B. �����ʾ��Һ�У�c��K+����c��HR������c��H2R����c��R2����
C. �����ʾ��Һ�У�c��H2R��+c��HR����+c��R2����=0.04 mol.L-1
D. �����ʾ��Һ�У�c��H+��=c��HR����+2c��H2R��+c��OH����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com