
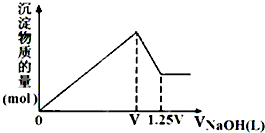
 有MgSO4、AlCl3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中Cl-与SO42-的物质的量浓度之比为( )
有MgSO4、AlCl3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中Cl-与SO42-的物质的量浓度之比为( )| A、1:1 | B、2:3 |
| C、3:1 | D、6:1 |


科目:高中化学 来源: 题型:
| A、浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 |
| B、Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
| D、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取干燥洁净的酸式滴定管立即装入标准盐酸 |
| B、用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定 |
| C、往盛有20.00mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定 |
| D、用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
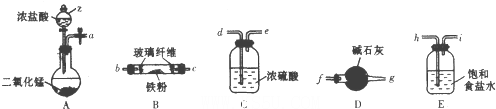
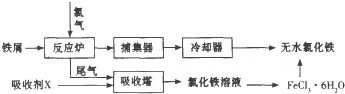
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Al3+、HCO3-、NO3- |
| B、AlO2-、Cl-、Mg2+、K+ |
| C、NH4+、Na+、CH3COO-、NO3- |
| D、Na+、NO3-、ClO-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
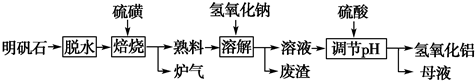
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com