
| A. | NH4NO3溶液与氢氧化钠共热:H++OH-═H2O | |
| B. | NH3•H2O滴入AlCl3溶液产生沉淀:3OH-+Al3+═Al(OH)3↓ | |
| C. | NaOH溶液与NaHCO3溶液混合:OH-+H+═H2O | |
| D. | Al(OH)3固体溶于稀硫酸中:Al(OH)3+3H+═Al3++3H2O |
分析 A.NH4NO3溶液与氢氧化钠共热生成硝酸钠和氨气和水,反应本质为铵根离子和氢氧根离子反应生成氨气和水;
B.一水合氨为弱电解质,应写化学式;
C.碳酸氢根离子为弱酸的酸根离子不能拆写;
D.氢氧化铝为难溶于水的碱,与硫酸发生中和反应.
解答 解:A.NH4NO3溶液与氢氧化钠共热,发生复分解反应生成硝酸钠和氨气和水,离子反应为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故A错误;
B.NH3•H2O滴入AlCl3溶液生成氯化铵和氢氧化铝沉淀,离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故B错误;
C.NaOH溶液与NaHCO3溶液混合反应生成碳酸钠和水,离子反应为HCO3-+OH-=H2O+CO32-,故C错误;
D.Al(OH)3固体溶于稀硫酸中,反应生成硫酸铝和水,离子反应为:Al(OH)3+3H+═Al3++3H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写,明确反应实质及离子反应实质是解题关键,注意化学式拆分,题目难度不大.


科目:高中化学 来源: 题型:填空题
 .下列能实现人工固氮的是D.
.下列能实现人工固氮的是D.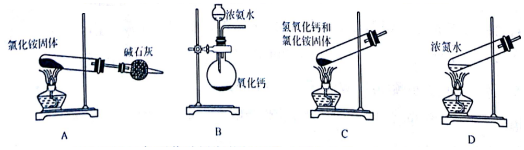
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取用粉末状固体或固体小颗粒时,应用药匙或纸槽,取用块状固体时,应用镊子夹取 | |
| B. | 取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管 | |
| C. | 胶头滴管取完一种试液后,可直接取另一种不与其反应的试液 | |
| D. | 当某实验没有准确的药品用量说明时,为看到明显现象,取用药品越多越好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g)?2NH3(g)△H<0 | B. | 2HI(g)?H2(g)+I2(g)△H>0 | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | D. | C(s)+H2O(g)?H2(g)+CO(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的氧化剂和还原剂的物质的量之比为3:2 | |
| B. | 被氧化和被还原的元素分别为铜和氮 | |
| C. | 当产生0.2 mol气体时,转移电子为0.6 mol | |
| D. | 被还原的CuO占参与反应CuO的$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
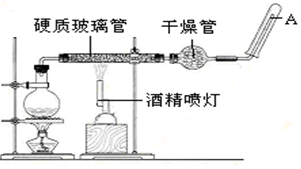
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
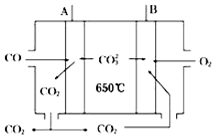 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com