
| A. | 该气体的摩尔质量 71 g•mol-1 | |
| B. | 标准况况下2.24 L该气体含电子数为1.7 NA | |
| C. | 将1mol该气体通入足量的NaOH中反应,转移电子数为 NA | |
| D. | 该气体的水溶液具有强氧化性,能杀菌消毒和漂白某些物质 |
分析 标况下,气体摩尔体积相等,体积相同的气体其物质的量相等,根据m=nM计算其摩尔质量,确定气体,根据气体具有的性质可进行回答判断.
解答 解:标况下,气体摩尔体积相等,充入氧气后,n(O2)=$\frac{132-100}{32}$mol=1mol,相同条件下,体积相等的不同气体,其物质的量相等,所以充入该气体的物质的量是1mol,其摩尔质量=$\frac{171-100}{1}$g/mol=71g/mol,所以气体是氯气.
A、氯气的摩尔质量 71 g•mol-1,故A正确;
B、标准况况下2.24 L该气体含电子数为$\frac{2.24L}{22.4L/mol}$×34NA=3.4NA,故B错误;
C、将1mol氯气入足量的NaOH中反应,Cl2+2NaOH=NaCl+NaClO+H2O,转移电子数为NA,故C正确;
D、氯气的水溶液中的HClO具有强氧化性,能杀菌消毒和漂白物质,故D正确.
故选B.
点评 本题考查阿伏伽德罗定律及其推论,明确相同条件下气体体积与物质的量的关系是解本题关键,熟练掌握物质的量的有关公式并灵活运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1 molAl3+含有的核外电子数为3NA | |
| B. | 将58.5g NaCl溶于1.00 L水中,所得NaCL溶液的浓度为1.00mol•L-1 | |
| C. | 1 molCl2与足量的铁反应,转移的电子为数3Na | |
| D. | 常温下,10LpH=1的硫酸溶液中含有的H+离子数为NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 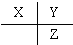 | B. | 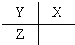 | C. | 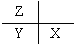 | D. | 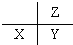 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 N2H+5+OH-.
N2H+5+OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;B:
;B: ;G:HCOOCH3
;G:HCOOCH3 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只用溴水一种试剂鉴别苯、己烯、乙醇、四氯化碳 | |
| B. | 用银氨溶液或NaHCO3溶液鉴别甲酸甲酯和乙酸两种液体 | |
| C. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加稀硫酸后加热使之水解,检验水解产物能否与新制Cu(OH)2悬浊液发生反应 | |
| B. | 浸入浓硝酸中,观察颜色是否变为黄色 | |
| C. | 在火中灼烧,闻其是否有烧焦羽毛的特殊气味 | |
| D. | 通过化学方法测其组成中是否含有硫、氮等元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com