
| A. | 1mol SiO2中含有NA个SiO2分子 | |
| B. | 1mol Cu与足量的稀HNO3反应,转移2 NA个电子 | |
| C. | 1 LO.1mol•L-1Na2CO3 溶液中含有 0.1NA 个CO${\;}_{3}^{2-}$ | |
| D. | 1mol苯乙烯中含有的碳碳双键数为4Na |
分析 A.二氧化硅晶体为原子晶体,不存在二氧化硅分子;
B.铜反应后生成铜离子,1mol铜完全反应失去2mol电子;
C.碳酸根离子部分水解,导致碳酸根离子数目减少;
D.苯分子中的碳碳键为一种介于单键和双键之间的独特键,不存在碳碳双键.
解答 解:A.二氧化硅晶体属于原子晶体,晶体中不存在二氧化硅分子,故A错误;
B.1mol铜与足量稀硝酸反应生成1mol铜离子,转移了2mol电子,转移2 NA个电子,故B正确;
C.1 L O.1mol•L-1Na2CO3 溶液中含有溶质碳酸钠0.1mol,由于碳酸根离子部分水解,在溶液中的碳酸根离子小于0.1mol,含有的碳酸根离子数目小于0.1NA,故C错误;
D.苯分子中不存在碳碳双键,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的计算与判断,题目难度中等,涉及苯的结构、盐的水解原理、原子晶体的构成微粒、氧化还原反应的计算等知识,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系为解答关键.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯制备环己烷 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 铜和浓硝酸为原料生产硝酸铜 | D. | 苯与硝酸反成制备硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )
肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )| A. | M的分子式为C10H10O2 | |
| B. | 1mol的M最多能被4molH2还原 | |
| C. | 如图可表示M的其中一种同分异构体的比例模型 | |
| D. | 与M含有相同官能团,且苯环上氢的化学环境只有两种的同分异构体有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
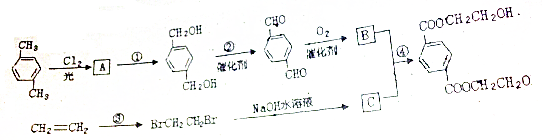
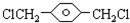 ,
,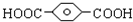 ,HOCH2CH2OH.
,HOCH2CH2OH.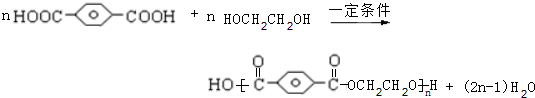 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 | |
| B. | 反应过程中I2置换出Cl2,由此可推断非金属性I>Cl | |
| C. | KClO3和KIO3均属于离子化合物,都只含有离子键 | |
| D. | 制备KIO3的反应中氯元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的年产量通常用来衡量一个国家的石油化工发展水平 | |
| B. | 煤的干馏属于物理变化 | |
| C. | 石油裂化的主要目的是除去石油中的杂质 | |
| D. | 压缩天然气和液化石油气的主要成分均为一氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率一定增大 | B. | 平衡一定向正反应方向进行 | ||
| C. | 反应物的转化率一定增大 | D. | 该反应的条件一定发生变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com