
| A. | NO2、NO、O2的物质的量之比是2:1:1 | |
| B. | 单位时间内生成1mol O2的同时生成2mol NO2 | |
| C. | 混合气体的颜色不再改变的状态 | |
| D. | 混合气体的平均相对分子质量不再改变的状态 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、当体系达平衡状态时,NO2、NO、O2的物质的量之比可能是2:1:1,也可能不是2:1:1,与各物质的初始浓度及转化率有关,故A错误;
B、单位时间内生成1mol O2等效于消耗2mol NO2,同时生成2mol NO2,正逆反应速率相等,达平衡状态,故B正确;
C、混合气体的颜色不再改变的状态,说明二氧化氮的物质的量浓度不变,正逆反应速率相等,反应达平衡状态,故C正确;
D、混合气体的平均相对分子质量不再改变的状态,说明气体的物质的量不变,正逆反应速率相等,反应达平衡状态,故D正确;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 在CH3COONa 溶液中滴入无色酚酞,溶液变红:CH3COO-+H2O?CH3COOH+OH- | |
| B. | 在Mg(OH)2白色悬浊液中滴入饱和FeCl3溶液,悬浊液变红褐:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ | |
| C. | 在NaHSO3溶液中滴加紫色石蕊溶液,溶液变红:NaHSO3=Na++H++SO32- | |
| D. | 在草酸溶液中滴入几滴稀H2SO4酸化的KMnO4溶液,溶液无色:2MnO4-+5H2C2O4+6H +=2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
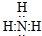 ,氯化铵
,氯化铵 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
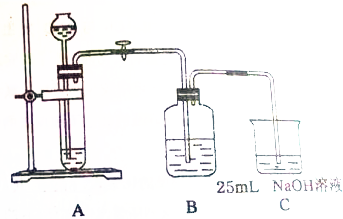 某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤:
某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
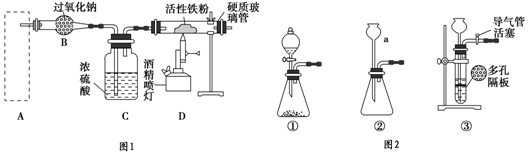
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| B. | CH4 (g)+2 O2(g)═CO2(g)+2 H2O (l)△H=-890.3 kJ•mol-1 | |
| C. | CH4(g)+2 O2(g)═CO2(g)+2 H2O (g)△H=-890.3 kJ•mol-1 | |
| D. | CH4(g)+2 O2 (g)═CO2(g)+2 H2O (l)△H=+890.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 金属性:Na>Al | C. | 稳定性:HF>CH4 | D. | 酸性:HClO<HClO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com