
A+B��X+Y+H2O��δ��ƽ����Ӧ������ȥ������ѧ������Ӧ�Ļ�ѧ����ʽ������A��B�����ʵ���֮��Ϊ1:4����ش�
��1����Y�ǻ���ɫ���壬��Y�ĵ���ʽ�� ���÷�Ӧ�Ļ�ѧ����ʽ�ǣ�
��
��2����AΪ�ǽ������ʣ���������ԭ�Ӻ��������������Ǵ�����������2����B����ҺΪijŨ�ᣬ��Ӧ���������뻹ԭ�������ʵ���֮���� ��
��3����AΪ�������ʣ�������A��B��Ũ��Һ�С��ۻ�������A������X��Һ��![]()
��AԪ�������ڱ��е�λ���� �����������ں��壩��Y�Ļ�ѧʽ�� ��
�ں�a mol X����Һ�ܽ���һ����A������Һ�����ֽ��������ӵ����ʵ���ǡ����ȣ���ԭ��X�� mol��
��4����A��B��X��Y��Ϊ�����A����ˮ������������Ӻ�ˮ���õ�������ɾ���ˮ����A��Һ�м��������ữ��AgNO3��Һ��������ɫ������B����ɫΪ��ɫ����A��B�����ʵ���֮��1:4ǡ�÷�Ӧ����Һ������Ũ�ȴӴ�С��˳���� ��
 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
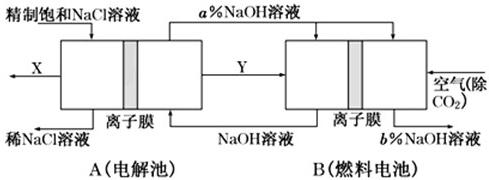 �ȼҵ��һ�ָߺ��ܲ�ҵ��һ�ֽ�ȼ�ϵ���������ϵ��¹��տɽ���30%���ϣ���ͼ�Ǹù���ͼʾ���缫δ�����������˵����ȷ���ǣ�������
�ȼҵ��һ�ָߺ��ܲ�ҵ��һ�ֽ�ȼ�ϵ���������ϵ��¹��տɽ���30%���ϣ���ͼ�Ǹù���ͼʾ���缫δ�����������˵����ȷ���ǣ�������| A��XΪH2��YΪCl2 | B��A��Ϊ���أ���m��n | C��B��Ϊȼ�ϵ�أ���b��a | D���ù����ŵ���ȼ�ϵ���ṩ������������ռ��Ʒ��Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A.(CO)a(CO2)x(H2O)y��(H2)a(CO2)x(H2O)y��(CO)b(H2)a-b(CO2)y(H2O)x
B.(CO)a(H2O)x(H2)b(CO2)x(H2O)y��(CO)a(H2)b(CO2)y(H2O)x
C.CaHb(CO2)x(H2O)y��CbHa(CO2)y��(H2O)x
D.Ca+1Hb-4(CO2)x(H2O)y��Ca-1Hb+4(CO2)y(H2O)x
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�긣��ʡ������ѧ��10�·��¿���ѧ�Ծ� ���ͣ�ѡ����
���¶ȡ�ѹǿ��������ý�������£����ܱ������г���N2��H2��NH3 ������ʼʱn(N2)=x mol��n(H2)=y mol��n(NH3)=z mol (x��y��z����Ϊ0 )��ƽ��ʱ��n(N2)=0.1mol��n(H2)=0.3mol��n(NH3)=0.08mol�������й��жϲ��������ǣ� ��
A��x : y =1 : 3
B��N2��H2��ת���ʲ����
C��ƽ��ʱ��H2��NH3����������֮��Ϊ3 : 2
D��x��ȡֵ��ΧΪ0��x��0.14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
.���¶ȡ�ѹǿ��������ý�������£����ܱ������г���N2��H2��NH3 ������ʼʱn(N2)=x mol��n(H2)=y mol��n(NH3)=z mol (x��y��z����Ϊ0 )��ƽ��ʱ��n(N2)=0.1mol��n(H2)=0.3mol��n(NH3)=0.08mol�������й��жϲ��������ǣ� ��
A��x : y =1 : 3
B��N2��H2��ת���ʲ����
C��ƽ��ʱ��H2��NH3����������֮��Ϊ3 : 2
D��x��ȡֵ��ΧΪ0��x��0.14
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com