
| 阳离子 | Ag+ Ba2+ A13+ |
| 阴离子 | OH- C1- SO42- |
分析 (1)从a知,B和D都不溶于水,也不溶于酸,B和D为是AgCl和BaSO4中一种.通过比较bc中“与上述某阳离子反应可生成B和D”知A和C中含有Cl- 和SO42-,而由两溶液与氨水生成白色沉淀可推知A和C阳离子均为 Al3+(可通过离子共存排除Ag+);从d知B为BaSO4(可通过E溶于水排除Ag+),D就为AgCl,进而知A为Al2(SO4)3,C为AlCl3;最后通过e知E为Ba(OH)2,据此进行解答;
(2)①氢氧化钡不足时,反应生成硫酸钡和氢氧化铝沉淀,离子方程式按照氢氧化钡的化学式组成书写;
②氢氧化钡过量时,氢氧化铝溶解,反应生成硫酸钡沉淀、偏铝酸钠和水.
解答 解:(1)B和D都不溶于水,也不溶于酸;则B和D为BaSO4和AgCl一种.由b可知A为铝盐,由c知C亦为铝盐,则推出E只能为Ba(OH)2,由A溶液与适量Ba(OH)2溶液反应生成沉淀,再加入过量Ba(OH)2溶液,沉淀量减少但不消失,
根据分析可知,B、C、D分别为BaSO4、AlCl3、AgCl,
故答案为:BaSO4;AlCl3;AgCl;
(2)A为AlCl3,E为Ba(OH)2,
①E为Ba(OH)2,氢氧化钡少量时,反应生成硫酸钡和氢氧化铝沉淀,反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓,
故答案为:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓;
②氢氧化钡过量时,反应生成硫酸钡沉淀、偏铝酸钠和水,反应的离子方程式为:2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2AlO2-+4H2O,
故答案为:2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2AlO2-+4H2O.
点评 本题考查常见离子的检验方法,为高频考点,题目难度中等,明确物质性质及物质之间反应是解本题关键,利用物质性质的特殊性进行分析推断,试题培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 糖类在一定条件下可以水解生成乙醇和二氧化碳 | |
| B. | 检验淀粉在稀硫酸催化条件下水解产物的方法:取适量水解液于试管中,加入少量新制Cu(OH)2溶液,加热,观察是否出现砖红色沉淀 | |
| C. | 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 | |
| D. | 蛋白质在紫外线、CuSO4溶液、福尔马林作用下均会发生变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都导致浓度偏大 | B. | ①导致浓度偏小,②导致浓度偏大 | ||
| C. | 都导致浓度偏小 | D. | ①导致浓度偏大,②导致浓度偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 K+.
K+.| 离子半径 | 非金属性 | 酸性 | 沸点 |
| F+<D2- | A<B | D的最高价氧化物的水化物<E的最高价氧化物的水化物 | C的氢化物>E的氢化物 |
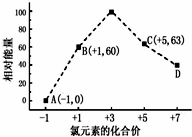
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. 等.
等.
 为原料制备化合物X(结构简式见图
为原料制备化合物X(结构简式见图 )
)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
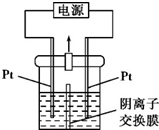 某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.
某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
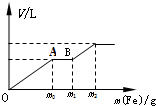 往一个盛有100mL的硝酸(浓度为1.0mol/L)和硫酸(浓度为2.0mol/L)的混和稀溶液中逐渐加入铁粉至反应停止,生成的气体与所加入铁粉的质量如下所示
往一个盛有100mL的硝酸(浓度为1.0mol/L)和硫酸(浓度为2.0mol/L)的混和稀溶液中逐渐加入铁粉至反应停止,生成的气体与所加入铁粉的质量如下所示查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com