
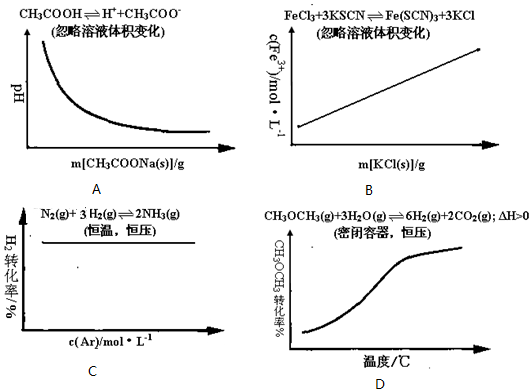
| A. | 向100mL 0.1mol/L醋酸溶液中逐渐加入醋酸钠晶体过程中溶液pH的变化趋势图 | |
| B. | 向FeCl3溶液和KSCN溶液混合后反应达平衡后,向混合液中逐渐加入固体KCl过程中c(Fe3+)的变化趋势图 | |
| C. | 密闭容器中进行N2(g)+3H2(g)?2NH3(g)反应达到平衡后,保持恒温恒压条件下,逐渐通入稀有气体Ar的过程中H2的转化率变化趋势图 | |
| D. | 密闭容器中进行CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g)△H>0达到平衡后,保持恒压条件下,逐渐升高温度过程中CH3OCH3的转化率变化趋势图 |
分析 A、醋酸溶液中逐渐加入醋酸钠晶体,同离子效应,抑制醋酸的电离,溶液的PH值变大;
B、根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变;
C、保持恒温恒压条件下,逐渐通入稀有气体Ar,体积变大,相当于减小压强,平衡逆向移动;
D、升高温度向吸热反应方向移动.
解答 解:A、醋酸溶液中逐渐加入醋酸钠晶体,同离子效应,抑制醋酸的电离,溶液的PH值变大,而不是减小,故A错误;
B、根据实际参加反应的离子浓度分析,化学平衡为Fe3++3SCN-=Fe(SCN)3,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,溶液颜色不变,故B错误;
C、保持恒温恒压条件下,逐渐通入稀有气体Ar,体积变大,相当于减小压强,平衡逆向移动,所以H2的转化率减小,而不是不变,故C错误;
D、升高温度向吸热反应方向移动,所以保持恒压条件下,逐渐升高温度过程中CH3OCH3的转化率变大,所以图象符合,故D正确;
故选D.
点评 本题考查化学平衡的影响因素分析判断,注意建立平衡的微粒分析应用,掌握基础是关键,题目难度中等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 40% | C. | 50% | D. | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
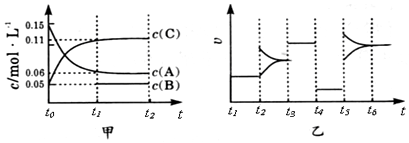
| A. | 该反应一定是放热反应 | B. | t4~t5阶段改变的条件为减小压强 | ||
| C. | B的起始物质的量为0.02mol | D. | 该反应的化学方程式为3A(g)+B(g)?2C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混乱度增大,而能量降低 | B. | 混乱度降低,而能量增大 | ||
| C. | 混乱度降低,而能量降低 | D. | 混乱度增大,而能量增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子电子层数增大 | |
| B. | 元素原子最外层电子数呈现周期性变化 | |
| C. | 元素的化合价呈现周期性变化 | |
| D. | 核电荷数依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5(b-2a)mol/L | B. | 5(b-2a)mol/L | C. | 0.5(b-a)mol/L | D. | 10(b-2a)mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com