
分析 (1)Cu2++2OH-=Cu(OH)2↓可以表示可溶性铜盐与可溶性强碱反应生成氢氧化铜沉淀和可溶性盐;
(2)H++OH-=H2O可以表示强酸或者强酸的酸式盐与可溶性强碱反应生成可溶性盐和水;
(3)HCO3-+H+=CO2↑+H2O表示可溶性碳酸氢盐与可溶性强酸或者可溶性强酸的酸式盐反应生成二氧化碳和水和可溶性盐.
解答 解:(1)Cu2++2OH-=Cu(OH)2↓可以表示可溶性铜盐与可溶性强碱反应生成氢氧化铜沉淀和可溶性盐,例如硫酸铜与氢氧化钠反应生成氢氧化铜和硫酸钠,方程式:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
故答案为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
(2)H++OH-=H2O可以表示强酸或者强酸的酸式盐与可溶性强碱反应生成可溶性盐和水,例如盐酸与氢氧化钠反应生成氯化钠和水,方程式:HCl+NaOH=NaCl+H2O;
故答案为:HCl+NaOH=NaCl+H2O;
(3)HCO3-+H+=CO2↑+H2O表示可溶性碳酸氢盐与可溶性强酸或者可溶性强酸的酸式盐反应生成二氧化碳和水和可溶性盐,例如碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,方程式:NaHCO3+HCl=CO2↑+H2O+NaCl;
故答案为:NaHCO3+HCl=CO2↑+H2O+NaCl.
点评 本题考查了离子方程式、化学方程式的书写,明确离子方程式的意义及书写方法是解题关键,注意化学式的拆分,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的 刻度(mL) | ||
| 第①次 | 10.00 | 0.40 | 20.50 |
| 第②次 | 10.00 | 4.10 | 24.00 |
| 第③次 | 10.00 | 2.20 | 23.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
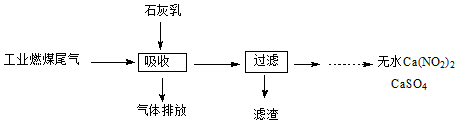
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P2O5可用于干燥Cl2和NH3 | |
| B. | NO2溶于水时发生氧化还原反应 | |
| C. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| C | 1000 | 1 | 2 | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
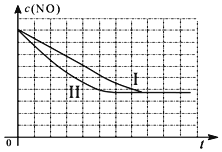
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图中的两条线分别代表的是:1g C3H6和1g M气体在相同容积的容器中,测得容器中的压强和温度的关系,试根据图形判断M气体的相对分子质量为( )
如图中的两条线分别代表的是:1g C3H6和1g M气体在相同容积的容器中,测得容器中的压强和温度的关系,试根据图形判断M气体的相对分子质量为( )| A. | 63 | B. | 28 | C. | 42 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据反应MnO4-+5Fe2++8H+=Mn2-+5Fe3++4H2O可知,用酸性KMnO4溶液可检验FeSO4•7H2O是否变质 | |
| B. | 用CO2鉴别NaAlO2溶液和CH3COONa溶液 | |
| C. | 用湿润的碘化钾淀粉试剂鉴别Br2(g)和NO2 | |
| D. | 用KOH溶液鉴别SO3(g)和SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com