
| A. | 淀粉遇到KI溶液呈现特殊蓝色 | |
| B. | 淀粉和纤维素属于多糖,其分子式均为(C6H10O5)n,二者互为同分异构体 | |
| C. | 多糖一般不溶于水,没有甜味,没有还原性 | |
| D. | 在稀硫酸作用下,淀粉水解生成葡萄糖和果糖 |
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取20.00 g NaOH固体 | |
| B. | 向用水润湿的pH试纸上滴盐酸,可测定盐酸的pH | |
| C. | 用电子分析天平测得铁片质量是15.524 g | |
| D. | 在配制一定物质的量浓度的溶液时,定容后,经摇匀发现液面低于刻度线,此时再加入蒸馏水使其液面与刻度线持平 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式为2H2(g)+02(g)=2H20(1)△H=-285kJ•mol-1 | |
| B. | 等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多 | |
| C. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应转移电子的数小于0.6×6.02×1023 | |
| D. | 已知中和热为57.3kJ•mol-1,若将含0.5molH2S04的浓硫酸溶液与含1mol Na0H的溶液混合,放出的热量要小于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁、铝分别与热水反应 | |
| B. | 镁、铝分别与盐酸反应 | |
| C. | 氯化镁溶液、氯化铝溶液分别与氢氧化钠溶液反应 | |
| D. | 将镁-铝-氢氧化钠溶液设计为原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子中有1个氢原子与其他氢原子不一样 | |
| B. | 乙醇分子可认为是由乙烷分子中的一个-H被一个-OH取代产生的 | |
| C. | 乙醇分子中的每个碳原子都形成了四个共价键,但显示化合价不是+4价 | |
| D. | 乙醇的相对分子质量为46,相对分子质量为46的有机物就是乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+8+m-n | B. | a+18-m+n | C. | a+32-m-n | D. | a+24-m-n |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酸式滴定管未用标准盐酸润洗,直接装入标准盐酸 | |
| B. | 酸式滴定管滴定前有气泡,滴定后气泡消失 | |
| C. | 滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥 | |
| D. | 读取醋酸体积时,开始仰视读数,滴定结束后俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
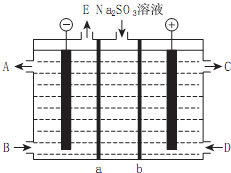
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
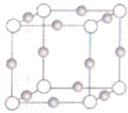 Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.
Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com