
| A. | 13.8g | B. | 69g | C. | 34.5g | D. | 138g |
科目:高中化学 来源: 题型:解答题
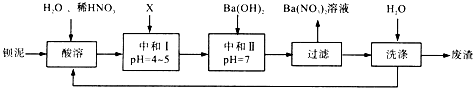
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加澄清的石灰水 | B. | 两者分别与同浓度的稀盐酸反应 | ||
| C. | 溶于水,比较其溶解性 | D. | 两者分别加入NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤是工业上获得苯、甲苯、二甲苯等芳香烃的重要来源 | |
| B. | 煤是由多种有机化合物组成的混合物,内含煤焦油等成分 | |
| C. | 煤除了含有C、H元素外,还含有少量的N、S、O等元素 | |
| D. | 煤等化石燃料的储量有限,节能和开发新能源是人类实现可持续发展的关键之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
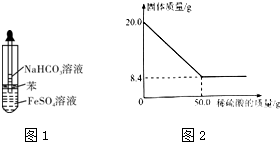
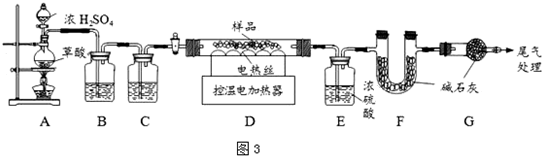
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和水反应:Na+H2O=Na++OH-+H2↑ | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O | |
| C. | 碳酸氢钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 工业上电解饱和食盐水的反应:2Na++2Cl-$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
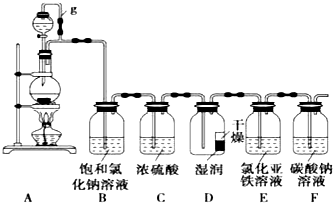 某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:
某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | $\frac{{c({H^+})}}{{c(O{H^-})}}={10^{-10}}$的溶液:K+、Ba2+、NO3-、Cl- | |
| C. | pH=0的溶液:Al3+、Cl-、SO42-、CO32- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、I-、S2-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com