
| A. | 不可将水直接倒入浓硫酸中进行稀释 | |
| B. | 浓硫酸可用于干燥O2、CO2 | |
| C. | 硝酸与铁反应可产生H2 | |
| D. | 浓硫酸对皮肤或衣服有很强的腐蚀性 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度下,在2L密闭容器中X、Y、Z三种气体进行反应,其物质的量随时间的变化曲线如图.
某温度下,在2L密闭容器中X、Y、Z三种气体进行反应,其物质的量随时间的变化曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
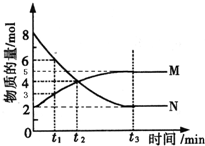 在一定温度下,4L密闭容器内存在反应2N?M,其中气体M、气体N的物质的量随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内存在反应2N?M,其中气体M、气体N的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>b | B. | 元素非金属性:Y>Z | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 离子半径:X+<Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol碳正离子(CH3+)所含的电子总数为8NA | |
| B. | 1mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5mol 1,3-丁二烯分子中含有碳碳双键数为NA | |
| D. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 金属 | 酸溶液的浓度和体积 | 温度/℃ |
| A | 2.4 g 锌片 | 3 mol•L -1硫酸50 mL | 40 |
| B | 2.4 g锌粉 | 1 mol•L-1硫酸200 mL | 30 |
| C | 2.4 g锌粉 | 3 mol•L-1硫酸50 mL | 40 |
| D | 5.6 g锌片 | 3 mol•L-1硫酸1 00 mL | 30 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com