
在200mLFeCl3和FeCl2混合液中加入0.56g铁粉,恰好完全反应,使溶液中无Fe3+,此时向溶液中通入适量的氯气,正好将溶液中的Fe2+全部氧化为Fe3+,再继续向溶液中滴加足量的硝酸银溶液得到白色沉淀43.05g。求原混合液中FeCl3和FeCl2的物质的量浓度。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
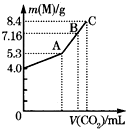 往100mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M.通入的CO2的体积(标准状况)与M的质量的关系如图所示.
往100mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M.通入的CO2的体积(标准状况)与M的质量的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | A | B |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和3mol H2O(g) |
| CH3OH(g)浓度(mol?L-1) | c1 | c2 |
| 反应能量变化 | 放出29.4kJ | 吸收akJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在200mLFeCl3和FeCl2的混合溶液中,加入0.01 mol铁粉恰好完全反应,溶液中无Fe3+,取反应后溶液的与Cl2反应,溶液中Fe2+有80%被氧化成Fe3+,向通入Cl2后的溶液中再滴入AgNO3溶液,产生白色沉淀0.028 mol,求原溶液中FeCl3和FeCl2的物质的量浓度各多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com