
| A、常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| B、25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
| C、50mL 18.4mol?L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
| D、常温下,1L 0.1mol?L-1的NH4NO3溶液中氧原子数为0.3NA |


科目:高中化学 来源: 题型:

| A、若A为醋酸,B为贝壳(粉状),D中盛C6H5ONa溶液,则D中溶液变浑浊 |
| B、若A为食盐水,B为电石,D中盛KMnO4酸性溶液,则D中溶液紫色褪去 |
| C、若A为浓氨水,B为生石灰,D中盛AgNO3溶液,则D中不会出现新的现象变化 |
| D、实验中仪器C可起到防止倒吸的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Ba2+、Mg2+、NO3- |
| B、Cl-、CO32-、Cu2+、Mg2+ |
| C、NO3-、SO42-、K+、OH- |
| D、NO3-、HCO3-、Ba2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍,下列说法正确的是( )| A、X的气态氢化物比Y的强 |
| B、Y的氧化物对应的水化物酸性比Z强 |
| C、W的非金属性比Z强 |
| D、X与Y形成的化合物都易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 实验室制取并收集氨气 |
B、 制取SO2并检验SO2的漂白性 |
C、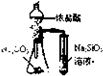 比较氯碳硅三种元素的非金属性强弱 |
D、 除去CO2中的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阴极产物为H2 |
| B、阳极先析出Cl2,后析出O2 |
| C、电解液的pH不断增大,最终大于7 |
| D、整个电解的过程实质是电解水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.回答下列问题:
纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com