
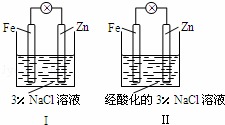
结合图判断,下列叙述正确的是( )
|
| A. | Ⅰ和Ⅱ中正极均被保护 |
|
| B. | Ⅰ和Ⅱ中负极反应均是:Fe﹣2e﹣═Fe2+ |
|
| C. | Ⅰ正极反应是:O2+2H2O+4e﹣═4OH﹣ |
|
| D. | Ⅰ和Ⅱ中分别加入少量KSCN溶液,溶液均变红 |
考点:
原电池和电解池的工作原理.
专题:
电化学专题.
分析:
锌比铁活泼,装置Ⅰ中锌做负极,负极反应为:Zn﹣2e﹣=Zn2+,铁做正极,溶液呈中性,发生吸氧腐蚀,正极反应为:O2+2H2O+4e﹣=4OH﹣;
装置Ⅱ中Zn为负极,电解质溶液呈酸性,所以正极的反应式为2H++2e﹣=H2↑,负极反应式为:Zn﹣2e﹣=Zn2+,以此解答该题.
解答:
解:A.题给装置I、II都是原电池,活泼金属作负极,首先被腐蚀,不活泼金属作正极,被保护,故A正确;
B.锌比铁活泼,为原电池的负极,电极方程式为Zn﹣2e﹣=Zn2+,故B错误;
C.I溶液显中性,发生吸氧腐蚀,正极电极反应式为:O2+2H2O+4e﹣=4OH﹣,故C正确;
D.Ⅰ和Ⅱ中没有Fe3+生成,加入KSCN溶液不变色,故D错误.
故选AC.
点评:
本题考查了原电池原理的分析判断,为高频考点,侧重于学生的分析能力的考查,注意电解质溶液不同,电极与电极反应变化,题目难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到如图,则曲线a、b、c、d所对应的实验组别可能是()
组别 c(HCl)(mol/L) 温度(℃) 状态
1 2.0 25 块状
2 2.5 30 块状
3 2.5 50 块状
4 2.5 30 粉末状
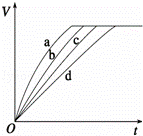
A. 4﹣3﹣2﹣1 B. 1﹣2﹣3﹣4 C. 3﹣4﹣2﹣1 D. 1﹣2﹣4﹣3
查看答案和解析>>
科目:高中化学 来源: 题型:
1,6﹣已二酸(G)是合成尼龙的主要原料之一,可用含六个碳原子的有机化合物氧化制备.如图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F):
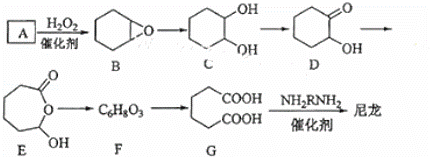
回答下列问题:
(1)化合物A中含碳87.8%,其余为氢,A的化学名称为 .
(2)B到C的反应类型为 .
(3)F的结构简式为 .
(4)在上述中间物质中,核磁共振氢谱出峰最多的是DE,最少的是F.(填化合物代号)
(5)由G合成尼龙的化学方程式为 .
(6)由A通过两步反应制备1,3﹣环已二烯的合成路 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下某密闭容器中,可逆反应A(g)+3B(g)⇌2C(g)+2D(s)达到平衡,下列描述一定正确的是( )
①C的生成速率与C的分解速率相等 ②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化 ④反应物的转化率不再变化
⑤混合气体的压强不再变化 ⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB ⑧A、B、C、D的分子数之比为1:3:2:2.
|
| A. | ①②③④⑤⑥⑦ | B. | ①③④⑤⑥⑦ | C. | ①③④⑥⑦ | D. | ①③⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应:N2(g)+3H2(g)⇌2NH3(g)△H<0.在等容条件下进行.体系中各物质浓度随时间变化的曲线如图1所示,回答问题:
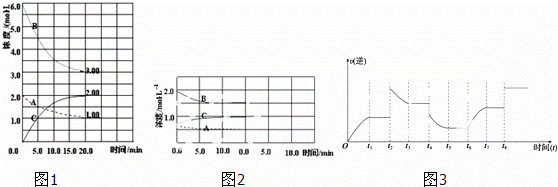
(1)图1中B为 (填“N2”、“H2”或“NH3”)计算反应从开始→达平衡时H2的反应速率v(H2)=
(2)图1是在某温度下反应达到平衡,将容器的体积扩大一倍,假定10min后达到新的平衡,请在图2中用曲线表示体系中各物质的浓度随时间变化的趋势(不需计算新平衡时的具体浓度,只要新平衡时浓度处于一个合理范围内即可.曲线上必须标出N2、H2、NH3).
(3)若该反应的逆反应速率与时间的关系如图3所示:反应在t1、t3、t5、t7时都达到了平衡,而t2、t4、
t6、t8时都改变了条件,试判断改变的条件是(填“升温”、“降压”…等);t2时 ;t6时 ;t4时,平衡向 (填“正”或“逆”)反应方向移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表归纳是学习化学的一种常用科学方法,某同学做出了如图所示的归纳,下列对应正确的是( )
选项-X-Y-Z
A-混合物-溶液-胶体
B-酸-强酸-硫酸
C-纯净物-无机物-甲烷
D-化合物-碱性氧化物-酸性氧化物
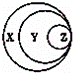
-A.-A-B.-B-C.-C-D.-D
查看答案和解析>>
科目:高中化学 来源: 题型:
所含分子数相同的一组物质是( )
|
| A. | 1gH2和1gN2 | B. | 1molH2O和1gH2O |
|
| C. | 3.2gO2和4.8gO3 | D. | 44gCO2和16gO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com