
| m |
| M |
| V |
| Vm |


科目:高中化学 来源: 题型:
| A、50×18×6.02×1023 |
| B、6.02×1023/50 |
| C、6.02×1023/50×18 |
| D、50×6.02×1023/18 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 成分 | 催化氧化前 | 催化氧化后 |
| O2 | 11% | 未测定 |
| SO2 | 7% | 未测定 |
| N2 | 82% | 84% |
| SO3 | -- | 7% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
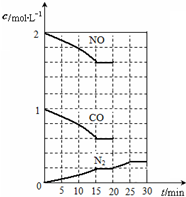 降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
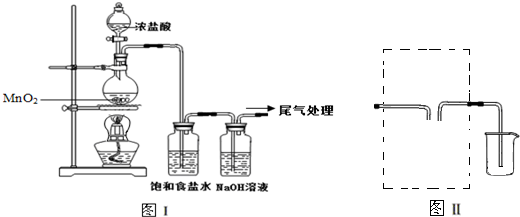
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的PH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水煤气(CO,H2)是二级能源 |
| B、水力是二级能源 |
| C、天然气是二级能源 |
| D、电能是一级能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com