
【题目】某无色透明的溶液中,能大量共存的离子组是( )
A. Na+、H+、SO42-、HCO3- B. Cu2+、K+、SO42-、NO3-
C. Na+、K+、Cl-、NO3- D. Ba2+、K+、SO42-、Cl-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某同学设计如图所示装置分别进行探究实验(夹持装置已略去) 
实验 | 药品 | 制取气体 | 量气管中的液体 |
① | Cu、稀HNO3 | H2O | |
② | NaOH固体、浓氨水 | NH3 | |
③ | Na2CO3固体、稀H2SO4 | CO2 | |
④ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
请回答下列问题:
(1)简述如何检查该装置的气密性: .
(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度.你认为是否可行?请简述原因. .
(3)实验②中剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3 , 而且能防止倒吸的有
(4)实验③中,量气管中的液体最好是 .
A.H2O
B.CCl4
C.饱和Na2CO3溶液
D.饱和NaHCO3溶液
(5)本实验应对量气管多次读数,读数时应注意: ①恢复至室温,② , ③视线与凹液面最低处相平.
(6)实验④获得以下数据(所有气体体积均已换算成标准状况)
编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
① | 1.0g | 10.0mL | 346.3mL |
② | 1.0g | 10.0mL | 335.0mL |
③ | 1.0g | 10.0mL | 345.7mL |
根据上述合理数据计算镁铝合金中铝的质量分数 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1.0molL﹣l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( ) 
A.0.5 molL﹣1、160 mL
B.1.0 molL﹣1、160 mL
C.0.5 molL﹣1、80 mL
D.1.0 molL﹣1、80 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~J是中学化学中常见的几种物质,它们之间的转化关系如图所示.已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作杀菌消毒剂.
(1)写出B的电子式 .
(2)写出反应⑤的化学方程式: .
(3)写出反应⑦的离子方程式: .
(4)向AlCl3溶液中加入少量固体B,写出反应的化学方程式: .
(5)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则极(填“阴”或“阳”)附近溶液先由无色变为红色,请说明理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多变化中存在着能量的变化,请回答下列问题:
(1)从化学键角度上看,化学反应的本质是____________。
已知反应2N2(g)+6H2O(1) ![]() 4NH3(g)+3O2(g),反应过程中的能量变化如图所示:
4NH3(g)+3O2(g),反应过程中的能量变化如图所示:
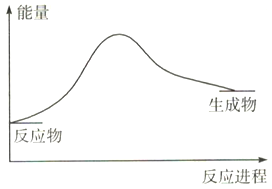
则反应中断裂的化学键是_______(用相应化学键的符号表示),该反应是_____(填“吸热”或“放热”)反应。4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(1)中,该反应中反应物的总能量____(填“>”或“<”)生成物的总能量。
2N2(g)+6H2O(1)中,该反应中反应物的总能量____(填“>”或“<”)生成物的总能量。
(2)写出一个属于吸热反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是化学研究中常用的方法。下列分类方法中,不正确的是
A.依据分子中含有的氢原子的数目,将酸分为一元酸、二元酸等
B.依据在水溶液中或熔融状态下能否导电,将化合物分为电解质和非电解质
C.依据分散质粒子的大小,将分散系分为溶液、胶体、浊液
D.依据组成的元素的种类,将纯净物分为单质和化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 三聚氰酸(C3H3N3O3)的结构式为 ,它属于共价化合物
,它属于共价化合物
B. 只含H、N、O三种元素的化合物,可能是离子化合物,也可能是共价化合物
C. NaHCO3、CH3COONa均含有离子键和共价键
D. 化合物MgO、H2O中化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校为了改进碳与HNO3反应的实验,设计了如图所示的装置:先预热盛有无水CaCl2的试管I,然后投入几小块红热的炭块,再缓缓地向炭块上滴加浓HNO3 , 反应即可连续进行.
(1)由于浓HNO3易挥发,应怎样操作才能使分液漏斗中HNO3顺利滴下? .
(2)写出试管I中的化学方程式: .
(3)试管Ⅱ上方的长颈漏斗中放置一团湿棉花.其作用是 .
(4)试管Ⅱ中的现象: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 
(1)环形玻璃搅拌棒的作用是 .
(2)中和反应放出的热量会造成少量盐酸在反应中挥发,则测得的中和热的数值(填“偏大”、“偏小”或“不变”).
(3)该实验小组做了三次实验,每次取溶液各50mL,并将实验数据记录如表:
实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2﹣t1)℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 31.8 | 6.8 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4.18×10﹣3kJ/(g℃),则该反应的中和热△H= .
(4)在中和热测定实验中,测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热的数值(填“偏大”、“偏小”或“不变”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com