
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定存在.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定存在.
分析 Ⅰ.(1)硫粉难溶于水、微溶于乙醇,乙醇湿润可以使硫粉易于分散到溶液中;
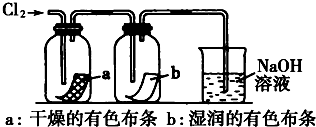
(2)根据图示装置中仪器构造写出其名称,然后根据冷凝管能够起到冷凝回流的作用进行解答;
(3)由于S2O32?具有还原性,易被氧气氧化成硫酸根离子可知杂质为硫酸钠;根据检验硫酸根离子的方法检验杂质硫酸钠;
(4)S2O32?与氢离子在溶液中能够发生氧化还原反应生成硫单质,据此写出反应的离子方程式;
Ⅱ.(1)根据滴定前溶液为无色,滴定结束后,碘单质使淀粉变蓝,判断达到终点时溶液颜色变化;
(2)根据图示的滴定管中液面读出初读数、终读数,然后计算出消耗碘的标准溶液体积;根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),然后根据题中碘单质的物质的量计算出Na2S2O3•5H2O质量及产品的纯度;
Ⅲ.根据题干信息“Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-”及化合价升降相等写出反应的离子方程式.
解答 解:Ⅰ.(1)硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇湿润是使硫粉易于分散到溶液中,
故答案为:使硫粉易于分散到溶液中;
(2)根据题中图示装置图可知,仪器a为冷凝管,该实验中冷凝管具有冷凝回流的作用,
故答案为:冷凝管;冷凝回流;
(3)S2O32?具有还原性,能够被氧气氧化成硫酸根离子,所以可能存在的杂质是硫酸钠;检验硫酸钠的方法为:取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4,
故答案为:Na2SO4; 取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4;
(4)S2O32?与氢离子发生氧化还原反应生成淡黄色硫单质,反应的离子方程式为:S2O32?+2H+=S↓+SO2↑+H2O,
故答案为:S2O32?+2H+=S↓+SO2↑+H2O;
Ⅱ.(1)滴定结束后,碘单质使淀粉变蓝,所以滴定终点时溶液颜色变化为:由无色变为蓝色,
故答案为:由无色变为蓝色;
(2)根据图示的滴定管中液面可知,滴定管中初始读数为0,滴定终点液面读数为18.10mL,所以消耗碘的标准溶液体积为18.10mL;
根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),所以W g产品中含有Na2S2O3•5H2O质量为:0.1000 mol•L-1×18.10×10-3L×2×M=3.620×10-3Mg,则产品的纯度为:$\frac{3.620×10{\;}^{-3}Mg}{Wg}$×100%=$\frac{3.620×10{\;}^{-3}M}{W}$×100%,
故答案为:18.10;$\frac{3.620×10{\;}^{-3}M}{W}$×100%;
Ⅲ.Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,根据化合价升降相等配平后的离子方程式为:S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+,
故答案为:S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+.
点评 本题考查了化学实验基本操作方法及常见仪器的构造、离子的检验方法、中和滴定存在即计算、离子方程式的书写等知识,题目难度较大,试题涉及的题量较大,知识点较多,充分考查了学生对所学知识的掌握情况.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用5mL量筒准确量取4.55mL水 | |
| B. | 称量4.5g纯碱时,将纯碱放在称量纸上置于托盘天平的右盘,将砝码放在托盘天平的左盘 | |
| C. | 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤 | |
| D. | 萃取操作时,选择萃取剂的密度可以比水大也可以比水小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,加热、易分解,在酸性溶液中不能稳定存在.工业上常用亚硫酸钠法、硫化碱法等制备.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,加热、易分解,在酸性溶液中不能稳定存在.工业上常用亚硫酸钠法、硫化碱法等制备.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| C. | H3O+和NH4+具有的电子数相同 | |
| D. | 用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ/mol; |
| ② | 2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol; |
| ③ | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/moL; |
| ④ | C(s)+O2(g)═CO2(g)△H=-393.5kJ/moL; |
| ⑤ | CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H=+802kJ/moL |
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H |
| 键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 |
| A. | H2燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ/mol | |
| B. | 热化学方程式:C(s)+H2O(g)?H2(g)+CO(g)△H=+175.5kJ/moL | |
| C. | CH4的燃烧热△H=-802kJ/moL | |
| D. | 估算出C=O键能为800kJ/moL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃同系物随相对分子质量增大,熔点、沸点逐渐升高;常温下的状态由气态递变到液态,相对分子质量大的则为固态 | |
| B. | 烷烃同系物都能使溴水、KMnO4溶液褪色 | |
| C. | 烷烃跟卤素单质在光照条件下能发生取代反应 | |
| D. | 烷烃同系物的密度随相对分子质量增大逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥ | B. | ①②⑤⑥⑦ | C. | ①③④⑥ | D. | ②⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com