
【选修3-物质的结构与性质】(15分)
上表为周期表的一部分,其中的编号代表所对应的元素。请回答下列问题:
(1)⑨号元素的基态原子的价电子排布式是________,与其同周期,且基态原子的核外未成对电子数最多的元素是______(写出元素符号),②号元素基态原子的电子排布图为___。
(2) ①号与③号元素形成的含有18电子的物质为________(写出名称),②号与③号元素形成的,能造成温室效应的物质的空间构型为________。
②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为________(用对应的元素符号表示),常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是____________。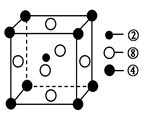
(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,有关该分子的说法中正确的是________。
a.该分子属于含有极性键的非极性分子b.该分子含有4个σ键和1个π键
c.该分子中的②原子采取sp2杂化d.该物质易溶于水,并能和水反应得到酒精
(4)某元素的价电子排布式为nsnnpn+1,该元素可与元素①形成含有10个电子的分子X,将过量的X通入盛有硫酸铜溶液的试管里,产生的现象为_______。
(5) 若D元素与Fe元素形成某种晶体如图所示。若晶胞的边长为a nm,则合金的密度为________g/cm3。
(1) 3d104s1 (1分) Cr (1分) 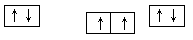
(1分)
(2) 过氧化氢 (1分) 直线型 (1分) MgNi3C或Ni3MgC (2分)
甲醇分子间存在氢键,而丙烯分子间只有范德华力 (2分)
(3)ac (2分)
(4)先产生蓝色沉淀,后沉淀消失,溶液变成深蓝色 (2分)
(5 ) 0.92/a3或5.56×1023/(a3NA) (2分)
解析试题分析:(1)⑨号元素为铜元素,基态原子的价电子排布式是3d104s1,与其同周期,且基态原子的核外未成对电子数最多的元素的电子排布式为[Ar]3d54s1是Cr,②号元素为碳元素,基态原子的电子排布图 
(2) ①号元素氢与③号元素氧形成的含有18电子的物质为过氧化氢,②号元素碳与③号元 素氧形成的,能造成温室效应的物质二氧化碳的空间构型为直线型。根据晶胞的结构利用切割法判断,1个晶胞中含有1个碳原子,镁原子8×1/8=1个,镍原子6×1/2=3个,C、Mg、Ni三种元素的原子形成的晶体的化学式为MgNi3C或Ni3MgC,常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是甲醇分子间存在氢键,而丙烯分子间只有范德华力。
(3)C、H两种元素能形成多种平面形分子,其中有一种相对分子质量最小为 乙炔,a.该分子中碳氢键为极性键,分子结构对称,属于含有极性键的非极性分子,正确;b.该分子含有2个碳氢键和1个碳碳三键,共3个σ键和2个π键,错误;c.该分子为直线型,碳原子采取sp1杂化,错误;d、该物质微溶于水,错误,选a;
(4)某元素的价电子排布式为nsnnpn+1,该元素为氮元素,可与元素氢形成含有10个电子的分子氨气,将过量的氨气通入盛有硫酸铜溶液的试管里,先发生复分解反应后发生络合反应,产生的现象为先产生蓝色沉淀,后沉淀消失,溶液变成深蓝色。
(5) 根据晶胞的结构先确定1个晶胞中含有各原子的个数,进一步确定化学式,结合密度的定义及相关数学知识进行计算。无法确定D元素,无法计算
考点:考查元素周期表的结构、核外电子排布规律、晶体结构与性质。


科目:高中化学 来源: 题型:填空题
(1)非金属单质A是实验室里常用的惰性电极材料,A元素原子基态时的电子排布图为 。
(2)B原子基态时2p原子轨道上有3个未成对电子,下列叙述正确的是 (填字母序号)
a.B的气态氢化物的沸点在同族元素的氢化物中最低
b.B的第一电离能、电负性都比A的大
c.A的气态氢化物比B的气态氢化物稳定
d.A的含氧酸一定比B的含氧酸酸性强
(3)铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:
①[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从小到大的顺序为: 。
②SO42-空间构型是 。 写出一种与SO32-互为等电子体的分子 。
③NH4CuSO3中的金属阳离子的结构示意图为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X~R是元素周期表中的短周期元素,其性质或结构信息如下表:
| 元素 | X | Y | Z | W | R |
| 性质信息 | 能形成+7价的化合物 | 日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子 | 焰色反应为黄色 | 位于第IVA,是形成化合物种类最多的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分,根据表中10种元素,用元素符号或化学式填空。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | | ② | | |
| 3 | | | ③ | ④ | | ⑤ | ⑥ | ⑦ |
| 4 | ⑨ | ⑧ | | | | ⑩ | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的―1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是 ____________族。
(2)画出D元素的原子结构示意图____________。
(3)与E的氢化物分子所含电子总数相等的分子是____________(举一例、填化学式),离子是____________(举一例、填电子式)。
(4)A与C形成的化合物中含有的化学键的类型是____________。
(5)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)元素周期表是学习化学的重要工具,它隐含着许多信息和规律,下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【物质结构与性质】
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有________种;写出Cu+的核外电子排布式________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有________种,属于d区的元素有________种。
(3)CaO晶胞如所示,CaO晶体中Ca2+的配位数为 ;CaO的焰色反应为砖红色,许多金属或它们的化
合物都可以发生焰色反应,其原因是_______。
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是_______(填选项字母)。
A NaN3与KN3结构类似,前者晶格能较小
B晶体钾的晶胞结构如图所示: ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子
C氮的第一电离能大于氧
D氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为_______,CNO-的中心原子的杂化方式为______。
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+ (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]X++ xR- Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
、I.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。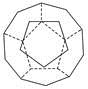
①C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数+棱边数=2,
请回答: C20分子共有________个正五边形,共有________条棱边。
II.A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D元素的核电荷数为29。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为________,1 mol该分子中含有π键的数目为________。该分子中碳原子的杂化轨道类型是__________________,该分子属于________分子(填“极性”或“非极性”)。
(3)基态D原子的电子排布式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(每空1分,共8分) 实验探究:探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各小题
填写所示仪器名称A B
(2)实验步骤:
连接仪器、_____________、加药品后,打开a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是 ;装置E中足量酸性KMnO4溶液的作用是 ;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是 ;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___(填“能”或“否”),试管D中发生反应的离子方程式是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com