
| A. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| B. | 鱼虾会产生不愉快的腥臭味,可在烹调时加入少量食醋和料酒 | |
| C. | 被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注入了甲酸的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| D. | 苯酚溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可使蛋白质变性凝固 |
分析 A.纤维素在人体中不水解,不能被人体吸收;
B.发出鱼腥味的物质是胺类化合物,蛋白质水解生成氨基酸,能和酸反应生成盐;
C.甲酸能和碱性物质反应生成盐;
D.强酸、强碱、重金属盐、乙醇等都能使蛋白质变性.
解答 解:A.人体内不含水解纤维素的酶,所以不能消化纤维素,因此纤维素不能被分解提供能量,故A错误;
B.发出鱼腥味的物质是胺类化合物,蛋白质水解生成氨基酸,氨基酸经脱羧作用产生二氧化碳和胺,烹调时加入少量食醋是为了中和,生成醋酸铵,盐没有特殊的气味,故B正确;C.甲酸是酸性物质能和碱反应生成盐,所以被蜂蚁蜇咬涂抹稀氨水或碳酸氢钠溶液,甲酸和氨水、碳酸氢钠等碱性物质反应生成盐,从而减轻疼痛,故C正确;
D.强酸、强碱、重金属盐、苯酚、乙醇等都能使蛋白质变性,病菌属于蛋白质,苯酚、酒精能使病菌变性,从而达到消毒目的,故D正确;
故选A.
点评 本题考查化学与生活有关知识,侧重考查了有机化合物的性质,明确物质的性质是解本题的关键,注意化学与生活的联系以及化学物质的性质,题目难度不大.


科目:高中化学 来源: 题型:解答题
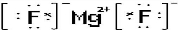 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,将1.12L Cl2溶于水,转移电子数为0.05NA | |
| B. | 将含等物质的量的KHCO3和Ba(OH)2溶液混合,离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 常温下,由水电离出的H+浓度为10-13mol•L-1的溶液中,Fe2+、Cl-、Na+、NO3-一定能大量共存 | |
| D. | 葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+可以大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
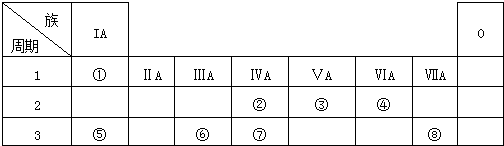
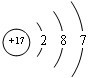 .
. ,②和⑦的气态氢化物的稳定性相比,其中较弱的是SiH4 (用该氢化物的化学式表示).
,②和⑦的气态氢化物的稳定性相比,其中较弱的是SiH4 (用该氢化物的化学式表示).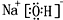 ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④正确 | B. | ①③正确 | C. | ②④正确 | D. | 只有①正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
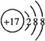 ,E元素的周期表位置第三周期ⅥA族,乙的电子式为
,E元素的周期表位置第三周期ⅥA族,乙的电子式为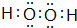 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
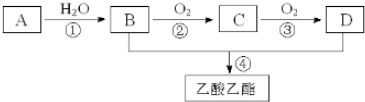
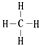
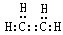 .
. ,取代反应.
,取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )
向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )| A. | 在a点,溶液pH>1 | |
| B. | 在b点,CH3COOH的Ka≈c(H+) | |
| C. | 在c点,c(CH3COO-)=c(Na+)=0.1 mol•L-1 | |
| D. | 在d点,c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com