
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
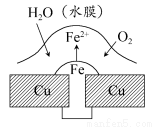
A.此过程中铜并不被腐蚀
B.此过程中电子从Fe移向Cu
C.正极反应式为:2H++2e-=H2↑
D.此过程中还涉及反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:选择题
有关水的电离平衡的说法正确的是( )
A.水的离子积通常用KW来表示,随温度变化而变化,只适用于纯水,在稀盐酸中数值会变大
B.在纯水中加入硫酸会抑制水的电离,加醋酸会促进水的电离
C.盐溶于水对水的电离平衡均没有影响
D.在纯水中加入氢氧化铁固体对水的电离平衡会有微弱的影响
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
如图表示某可逆反应在使用和未使用催化剂时,反应进程和能量的对应关系。下列说法一定正确的是( )
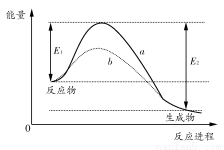
A.a与b相比,b的活化能更高
B.反应物断键吸收的总能量小于生成物成键释放的总能量
C.a与b相比,反应的平衡常数一定不同
D.a与b相比,a对应的反应速率更快
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:选择题
下列关于催化剂的说法不正确的是( )
A.温度越高,催化剂的催化效果越好
B.汽车排气管上的“催化转化器”能减少有害气体排放
C.催化剂可以改变化学反应速率,但反应前后质量和化学性质不变
D.锌与盐酸反应时,加入几滴硫酸铜溶液可加快反应速率,但硫酸铜不作催化剂
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(解析版) 题型:选择题
已知反应AsO43—+2I-+2H+ AsO32—+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
AsO32—+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流计指针均发生偏转。
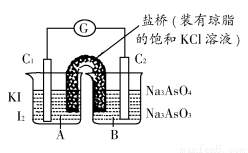
据此,下列判断正确的是( )
A.操作Ⅰ过程中,C1为正极
B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液
C.操作Ⅰ过程中,C2棒上发生的反应为:AsO43—+2H++2e-=AsO33—+H2O
D.操作Ⅱ过程中,C1棒上发生的反应为:2I-=I2+2e-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷(解析版) 题型:填空题
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的开关K时,观察到电流计的指针发生了偏转。
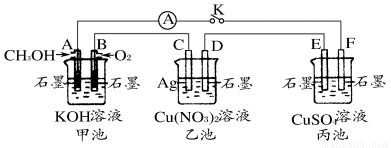
请回答下列问题:
(1)甲、乙、丙三池中为原电池的是__________(填“甲池”、“乙池”或“丙池”)。
(2)丙池中F电极为__________(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应式为__________。
(3)当乙池中C电极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为__________mL(标准状况)。
(4)一段时间后, 断开开关K。下列物质能使丙池恢复到反应前浓度的是__________(填选项字母)。
A.Cu B.CuO C.CuCO3 D.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷(解析版) 题型:选择题
实验发现,298 K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是( )
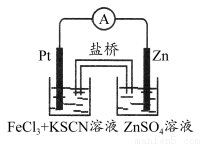
A.该原电池的正极反应是:Zn-2e-=Zn2+
B.左烧杯中溶液的红色逐渐褪去
C.该电池铂电极上有气泡出现
D.该电池总反应为:3Zn+2Fe3+=2Fe+3Zn2+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
C.已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol-1,②2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·mol-1,则a>b
D.已知:①C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.0 kJ·mol-1,则C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-3 含硅矿物与信息材料练习卷(解析版) 题型:填空题
金刚石、SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与短周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子。碳元素在周期表中的位置是____________,Q是____________,R的电子式为________。
(2)一定条件下,Na还原CCl4可制备金刚石。反应结束冷却至室温后,回收其中的CCl4的实验操作名称为________,除去粗产品中少量钠的试剂为________。
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2。现将20.0 g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1 mol氢气,过滤得SiC固体11.4 g,滤液稀释到1 L。生成氢气的离子方程式为__________________________________,硅酸盐的物质的量浓度为_________。
(4)下列叙述正确的有________(填序号)。
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
④钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com