
| A. | l8gNH4+中所含的电子数为11NA | |
| B. | 常温常压下,3.4gH2O2含有极性键的数目为0.2NA | |
| C. | 常温下,1L pH=1的H2SO4溶液中含有的H+的数目为0.2NA | |
| D. | 标准状况下,22.4LCl2完全溶于水时形成氯水时,转移电子数为NA |
分析 A、求出铵根离子的物质的量,然后根据铵根离子中含10个电子来分析;
B、求出双氧水的物质的量,然后根据双氧水中含2条极性键来分析;
C、pH=1的硫酸溶液中氢离子浓度为0.1mol/L;
D、氯气和水的反应为可逆反应.
解答 解:A、18g铵根离子的物质的量为1mol,而铵根离子中含10个电子,故1mol铵根离子中含10NA个电子,故A错误;
B、3.4g双氧水的物质的量为0.1mol,而双氧水中含2条极性键,故0.1mol双氧水中含0.2NA条极性键,故B正确;
C、pH=1的硫酸溶液中氢离子浓度为0.1mol/L,故1L溶液中含有的氢离子的物质的量为0.1mol,个数为0.1NA个,故C错误;
D、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
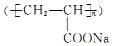 和苯甲酸异丙酯流程如下(部分条件已经略去):
和苯甲酸异丙酯流程如下(部分条件已经略去):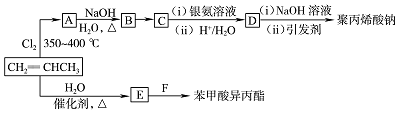
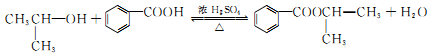 .
.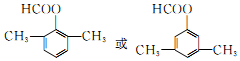 .
.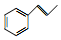 和F为原料(无机试剂任选),设计制备有机物
和F为原料(无机试剂任选),设计制备有机物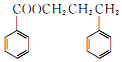 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量H2S:H+、Fe2+、Al3+、SO42- | |
| B. | 通入过量氨气:NH4+、A1O2-、OH-、SO42- | |
| C. | 加入过量NaC1O溶液:Fe3+、Na+、ClO-、SO42- | |
| D. | 加入过量NaOH溶液:Na+、A1O2-、OH-、SO42-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁能与酸反应,可用于制作红色涂料 | |
| B. | SO2具有漂白性,可在白葡萄酒中微量添加 | |
| C. | 钠钾合金硬度小,可用作原子反应堆的导热剂 | |
| D. | 酒精能使蛋白质变性,可在医疗上用来杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Na+、K+、Br-、CO32- | |
| B. | 0.1 mol/LCa(ClO)2溶液中:Fe2+、A13+、I-、SO42- | |
| C. | 0.1 mol/L Fe2(SO4)3溶液中:NH4+、Cu2+、NO3-、SO42- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13 mol/L的溶液中:Ca2+、NH4+、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
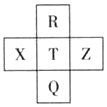 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | T的单质在化学反应中只表现氧化性 | |
| B. | R与Q的电子数相差16 | |
| C. | T形成的含氧酸的酸性一定比X形成的含氧酸强 | |
| D. | 在这五种元素中Z的化学性质最稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
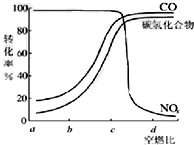 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.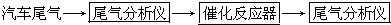
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com