
【题目】下表列出了核电荷数为21~25的元素的最高正化合价,回答下列问题:
元素名称 | 钪 | 钛 | 钒 | 铬 | 锰 |
元素符号 | Sc | Ti | V | Cr | Mn |
核电荷数 | 21 | 22 | 23 | 24 | 25 |
最高正价 | +3 | +4 | +5 | +6 | +7 |
(1) 按要求完成填充:
①Sc的价电子排布___________________________________________________________ ;
②Ti外围电子排布____________________________________________________________;
③用“原子实”表示V的核外电子排布___________________________________________;
④ 用轨道表示式表示Mn的特征电子排布 _______________________________________。
(2)已知基态铬原子的电子排布是1s22s22p63s23p63d54s1,并不符合构造原理。人们常常会碰到客观事实与理论不相吻合的问题,当你遇到这样的问题时,你的态度是_________________________。
(3)对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是_____出现这一现象的原因是________________________________________________________。
【答案】Sc: 3d14s2 Ti: 3d24s2 V: [Ar]3d34s2 Mn: ![]() 尊重客观事实,注重理论适用范围,掌握特例 五种元素的最高正化合价数值等于各元素基态原子的最高能层s电子和次高能层d电子数目之和 能量交错使得d电子也参与了化学反应
尊重客观事实,注重理论适用范围,掌握特例 五种元素的最高正化合价数值等于各元素基态原子的最高能层s电子和次高能层d电子数目之和 能量交错使得d电子也参与了化学反应
【解析】
(1)根据能量最低原理、泡利不相容原理、和洪特定则等可以写出核外电子排布;
(2) 碰到客观事实与理论不相吻合的问题,要尊重客观事实,注重理论适用范围,掌握特例;
(3)对比表格数据可以观察出现象和原因。
(1) ①Sc是第21号元素,位于第四周期,有四个电子层,最外层有3个电子,因为第4层的s轨道的能量比第3层的d轨道低,所以电子先排第4层s轨道的两个位置,再排第3层d轨道的一个位置,Sc的价电子排布为:3d14s2;
②Ti是第22号元素,位于第四周期,有四个电子层,最外层有4个电子,因为第4层的s轨道的能量比第3层的d轨道低,所以电子先排第4层s轨道的两个位置,再排第3层d轨道的2个位置,Ti的价电子排布为:3d24s2;
③V是第23号元素,位于第四周期,有四个电子层,最外层有5个电子,因为第4层的s轨道的能量比第3层的d轨道低,所以电子先排第4层s轨道的两个位置,再排第3层d轨道的3个位置,V的价电子排布为:3d34s2,用“原子实”表示V的核外电子排布为:[Ar]3d34s2;
④Mn是第24号元素,位于第四周期,有四个电子层,最外层有7个电子,因为第4层的s轨道的能量比第3层的d轨道低,所以电子先排第4层s轨道的两个位置,剩余5个电子再排第3层d轨道的5个位置,用轨道表示式表示Mn的特征电子排布为:![]() ;
;
(2) 已知基态铬原子的电子排布是1s22s22p63s23p63d54s1,并不符合构造原理。人们常常会碰到客观事实与理论不相吻合的问题,当遇到这样的问题时,态度应该是: 尊重客观事实,注重理论适用范围,掌握特例;
(3)对比这五种元素原子的核外电子排布与元素的最高正化合价,可以发现五种元素的最高正化合价数值等于各元素基态原子的最外层s电子和次外层d电子数目之和,出现这一现象的原因是能级交错使d电子也参与了化学反应。


科目:高中化学 来源: 题型:
【题目】常温下用0.10 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如下图。下列说法正确的是

A. 曲线I和曲线II分别代表的是CH3COOH和HCN
B. 点①和点②所示溶液中: ![]()
C. 点③和点⑤所示溶液中由水电离出的c(H+):⑤>③
D. 在点②和③之间(不包括端点)存在关系:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol·L-1 NaOH溶液滴定40 mL 0.1 mol·L-1 H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是( )
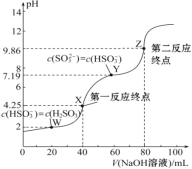
A. Ka2(H2SO3)的数量级为10-8
B. 若滴定到第一反应终点,可用甲基橙作指示剂
C. 图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
D. 图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
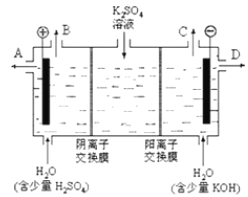
(1)该电解槽的阳极反应为________________________,此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2) 制得的氢氧化钾溶液从出口________(填写“A”、“B”、“C”、“D”)导出,制得的氧气从出口________ (填写“A”、“B”、“C”、“D”)导出。
(3)通电开始后,阴极附近溶液pH会增大,请简述原因_______________________________ 。
(4)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有相对原子质量均大于10的A、B两种元素,原子核内质子数等于中子数。它们能形成气态化合物X和Y。已知等物质的量的X和Y的混合物的密度是同条件下氢气密度的18.5倍,其中X和Y的质量比为3:4.4,经测定X的组成为AB,Y的组成为AnB,试通过计算确定:A、B各是什么元素______________?写出X、Y的化学式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是

A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,a、b、c……为部分元素。回答下列问题:
a | |||||||||||||||||
f | h | i | |||||||||||||||
b | e | j | |||||||||||||||
c | d | g | k | ||||||||||||||
l | |||||||||||||||||
(1)请写出d元素的原子结构示意简图:___________________________________;
(2)请写出i的单质与a、h形成的化合物发生反应的化学方程式_______________________;
(3)请写出上述元素组成的物质间发生的与“(2)”反应类型相同且有固体非金属单质生成的化学反应方程式________________________________________________;
(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出g元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式:______________________________________________________;
(5)j、k、l三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素单质的性质。请写出j、k的互化物与c、l形成的化合物等物质的量反应时的化学方程式________________。
(6)用电子式表示c、h两种元素以原子个数比1:1形成化合物的形成过程:______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如右图所示,具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病。有关原花青素的下列说法不正确的是( )

A. 该物质既可看做醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)

(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1______K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)。
a .容器内N2,H2,NH3的浓度之比为1:3:2 b. υ(N2)正=3υ(H2)逆
c .容器内压强保持不变 d. 混合气体的密度保持不变
③在400℃时,当测得NH3和N2,H2的物质的量分别为1mol和2mol,3mol时,则该反应的υ(N2)正______υ(N2)逆(填写“>,“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com