
| A. | 足量的钠在等物质的量的Cl2和O2中分别燃烧转移电子数 | |
| B. | 等物质的量的KO2与CaO2分别与水反应生成 的气体体积(相同条件下) | |
| C. | 100mL 1mol/L HNO3分别与1.4g Fe、2.8gFe完全反应时生成 的NO物质的量 | |
| D. | 等浓度等体积的盐酸、NaOH溶液分别与一定量Al反应生成等质量气体时转移的电子数 |
分析 A.Na与氯气生成NaCl,Na与氧气生成氧化钠;
B.根据反应方程式4KO2+2H2O=2KOH+3O2↑,2CaO2+2H2O=2Ca(OH)2+O2↑分析判断;
C.根据反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O计算;
D.反应生成的氢气相同,则H元素得到的电子相同.
解答 解:A.足量的钠在等物质的量的Cl2和O2中分别燃烧,Na与氯气生成NaCl,Na与氧气生成过氧化钠,Cl和O均生成-1价,所以转移电子数相同,故A不选;
B.KO2与CaO2分别与水反应生成氧气,两个反应的方程式分别为:4KO2+2H2O=2KOH+3O2↑,2CaO2+2H2O=2Ca(OH)2+O2↑,所以等物质的量的KO2与CaO2分别与水反应生成的气体体积不同,故B选;
C.100mL 1mol/L HNO3与1.4g Fe反应发生的方程式为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,二者恰好反应生成0.025molNO,3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,100mL 1mol/L HNO3分别与2.8gFe反应,硝酸的物质的量为0.1mol,Fe为0.5mol,发生3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,硝酸不足,按照硝酸计算得到NO为0.025mol,所以两个反应生成的NO相同,故C不选;
D.等浓度等体积的盐酸、NaOH溶液分别与一定量Al反应生成等质量的氢气,生成1mol氢气转移2mol电子,由于生成的氢气相同,所以转移的电子数相同,故D不选.
故选B.
点评 本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,注意把握物质存在的状态、构成以及物质的量的相关计算公式,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X-NO2 Y-SO2 Z-BaCl2 | B. | X-NH3 Y-SO2 Z-BaCl2 | ||
| C. | X-HCl Y-CO2 Z-Ca(OH)2 | D. | X-CO2 Y-SO2 Z-CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性:SiH4>PH3>H2S | D. | 非金属性:F>O>S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验装置 | 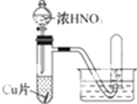 |  |
| 实验现象 | a.Cu片溶解溶液变成篮色. b.溶液中有气泡产生,大使管中充满红棕色气体气体,小试管中为无色气体 c、反应剧烈 | a、Cu片溶解,溶液变成蓝色. b.溶液中有气泡产生,大试管、小试管中均为无色气体 c.反应不剧烈 |
| 实验结论 | 浓硝酸具有氧化性,还原产物为NO2 | 稀硝酸具有氧化性,但不如浓硝酸强,还原产物为NO |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不吃或少吃使用了含铝食品添加剂的食物 | |
| B. | 不能用铝制器皿长期存放酸性或碱性食品 | |
| C. | 杜绝铝制品在生产生活中的应用 | |
| D. | 铝不属于重金属,它使人体中毒的原理与铅不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
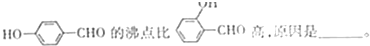
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MA不可能是强酸弱碱盐 | |
| B. | 反应后溶液中c(A-)=c(M+) | |
| C. | MOH一定是强碱 | |
| D. | 混合前酸与碱中溶质的物质的量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com