
【题目】实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气,所需实验装置如图所示:
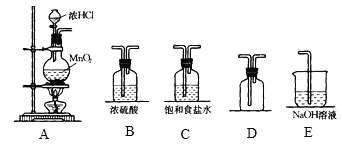
(1)写出装置A中装浓盐酸的仪器名称:______,装置A中发生反应的化学方程式:___________________。
(2)连接上述仪器,仪器的正确连接顺序是___________。
(3)NaOH溶液的作用是_________。
(4)将干燥的Cl2依次通过干燥的有色布条、湿润的有色布条,可观察到的现象是___________,得出的结论是_____________。
【答案】分液漏斗 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O ACBDBE 吸收尾气,防止污染空气 干燥的有色布条不褪色,湿润的有色布条褪色 干燥的氯气不具有漂白性,次氯酸具有漂白性
MnCl2+Cl2↑+2H2O ACBDBE 吸收尾气,防止污染空气 干燥的有色布条不褪色,湿润的有色布条褪色 干燥的氯气不具有漂白性,次氯酸具有漂白性
【解析】
在实验室中,用MnO2与浓盐酸混合加热制取氯气,由于浓盐酸具有挥发性,制取得到的氯气中含有杂质HCl和水蒸气,先通过饱和食盐水除去杂质HCl,然后通过浓硫酸干燥,再根据氯气的密度比空气大,用向上排空气方法收集,最后用NaOH溶液进行尾气处理。
(1)根据图示可知,盛有浓盐酸的仪器名称为分液漏斗;在装置A中MnO2与浓盐酸混合加热制取氯气,发生反应的化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)在装置A中制取氯气,通过装置C除去氯气中的杂质HCl,再通过装置B进行干燥,然后由装置D进行气体的收集,为防止最后尾气处理时溶液的水蒸气进入到收集装置,再连接使用装置B,最后用装置E进行尾气处理,所以仪器连接的正确连接顺序是ACBDBE;
(3)NaOH溶液可以与Cl2发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,故NaOH的作用是吸收尾气,防止污染空气;
(4)氯气没有漂白性,而氯气与水反应产生的HClO具有强的氧化性,可以将有色物质氧化变为无色,而具有漂白性,因此将干燥的Cl2依次通过干燥的有色布条、湿润的有色布条,可观察到的现象是干燥的有色布条不褪色,湿润的有色布条褪色,由此得出的结论是:干燥的氯气不具有漂白性,是Cl2与水反应的次氯酸具有漂白性。


科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等物质的量的氧气(O2)和臭氧(O3),所含的分子数之比为___,所含的氧原子数之比为___,其相对分子量之比为___,其质量之比为___;若O2和 O3质量相等,则其分子数之比为___,氧原子数之比___。
(2)一定条件下,硝酸铵受热分解的化学方程式为:5NH4NO3═2HNO3+4N2↑+9H2O,用双线桥标出电子转移情况___。5NH4NO3═2HNO3+4N2↑+9H2O,在该反应中是氧化产物___,被氧化与被还原的N原子个数之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料在疫情防控和治疗中起到了重要的作用。下列说法正确的是
A.聚乙烯是生产隔离衣的主要材料,能使酸性高锰酸钾溶液褪色
B.聚丙烯酸树脂是3D打印护目镜镜框材料的成分之一,可以与NaOH溶液反应
C.天然橡胶是制作医用无菌橡胶手套的原料,它是异戊二烯发生缩聚反应的产物
D.聚乙二醇可用于制备治疗新冠病毒的药物,聚乙二醇的结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。Z原子2p轨道上有3个未成对电子。甲、乙、丙、丁、戊是这四种元素之间形成的化合物,75%的甲溶液常用于消毒,戊是Z和X组成的10电子分子,常温下已溶液显中性,它们转化关系如图所示,则下列说法中错误的是
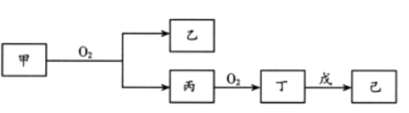
A.四种元素原子半径由大到小的顺序为:Y>Z>W>X
B.W的氢化物中的某一种具有漂白性
C.丙的电子式为![]()
D.W的氢化物沸点一定比Y的氢化物沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂/氟化碳电池稳定性很高。电解质为LiClO4的乙二醇二甲醚溶液,总反应为xLi+CFx=xLiF+C,放电产物LiF沉积在正极,工作原理如图所示。下列说法正确的是

A.正极的电极反应式为CFx+xe-+xLi+=xLiF+C
B.交换膜为阴离子交换膜
C.电解质溶液可用LiClO4的乙醇溶液代替
D.b极电势高于a极电势
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Cl2===2Cl﹣+2Fe3+,2Br﹣+Cl2===Br2+2Cl﹣,2Fe2++Br2===2Br﹣+2Fe3+。含有amol FeBr2的溶液中,通入xmol Cl2,下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A. x=0.4a,2Fe2++Cl2===2Fe3++2Cl﹣
B. x=0.6a,2Br﹣+Cl2===Br2+2Cl﹣
C. x=a,2Fe2++2Br﹣+2Cl2===Br2+2Fe3++4Cl﹣
D. x=1.5a,2Fe2++4Br﹣+3Cl2===2Br2+2Fe3++6Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现往体积固定的密闭容器中通入等物质的量的NO2和CO,反应中的CO和NO的浓度随时间变化的示意图如图。根据图意回答下列问题:
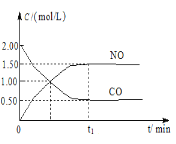
(1)从反应开始到平衡,用NO2浓度变化表示平均反应速率υ(NO2)=___。
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H<0。试回答:
CO2(g)+H2(g)△H<0。试回答:
①若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____。
②在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态___(填“是”与“否”),此时υ(正)__υ(逆)(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液(醋酸二氨合铜、氨水)吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应方程式为:Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac (Ac-为CH3COO-的简写)
[Cu(NH3)3CO]Ac (Ac-为CH3COO-的简写)
(1)基态原子中未成对电子数最多的短周期元素X,与上述反应中所有元素均不在同一周期,该基态原子的电子排布式为________。
(2) [Cu(NH3)3CO]Ac组成元素中,第一电离能最大的元素是________。(填元素符号)。
(3)HAc可通过将CH3CHO氧化得到,比较HAc与乙醛的沸点高低,并说明原因:________________。
(4)C、N两种原子可形气体分子 (CN)2,也可形成有剧毒性的CN-。(CN)2性质与卤素单质类似,判断(CN)2中C原子轨道杂化类型为________。与CN-互为等电子体的一种非极性分子的化学式为________。
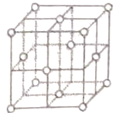
(5)铜晶胞结构如图,铜晶体中每个铜原子周围距离最近的铜原子数目为________。
 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com