
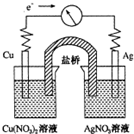
 将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是( )
将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是( )| A、KNO3盐桥中的K+移向Cu(NO3)2溶液 |
| B、Ag作负极,Cu作正极 |
| C、工作一段时间后,Cu(NO3)2溶液中c(Cu2+)增大 |
| D、取出盐桥后,电流计的指针依然发生偏转 |


科目:高中化学 来源: 题型:
| A、Na2CO3+H2SO4═Na2SO4+CO2↑+H2O |
| B、CaCO3+2HCl═CaCl2+CO2↑+H2O |
| C、KHCO3+HCl═KCl+CO2↑+H2O |
| D、BaCO3+2HNO3═Ba(NO3 )2+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
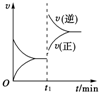 如图为某可逆反应的速率与时间的关系示意图,在t1时刻改变的条件为升温或增大压强,则该可逆反应可以是(提示:即升温或增大压强时均能符合如右图所示的速率与时间图象)( )
如图为某可逆反应的速率与时间的关系示意图,在t1时刻改变的条件为升温或增大压强,则该可逆反应可以是(提示:即升温或增大压强时均能符合如右图所示的速率与时间图象)( )| A、4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0 |
| B、2SO2(g)+O2(g)═2SO3(g)△H<0 |
| C、H2(g)+I2(g)═2HI(g)△H>0 |
| D、C(s)+H2O(g)═CO(g)+H2(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量 |
| B、c(CH3COO-)=c(Na+)时,醋酸与氢氧化钠恰好完全中和 |
| C、c(CH3COO-)=c(Na+)时,该溶液一定呈中性 |
| D、c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,可能是氢氧化钠过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
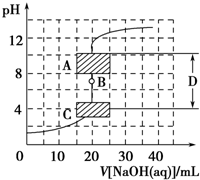 滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种.
滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种.查看答案和解析>>
科目:高中化学 来源: 题型:
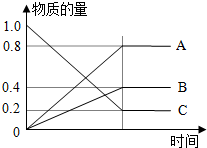 H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).
H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).查看答案和解析>>
科目:高中化学 来源: 题型:
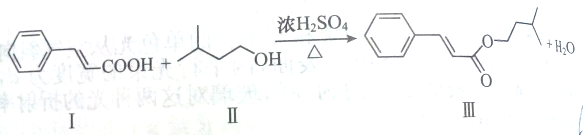
| A、Ⅱ物质的名称为2-甲基-4-丁醇 |
| B、Ⅲ物质的分子式为C14H18O2 |
| C、Ⅰ物质的9个碳原子一定共面 |
| D、Ⅲ物质中有3种官能团 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com