
氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:H2(g)+ O2(g)=H2O(l);△H=﹣285.8kJ/molCO(g)+
O2(g)=H2O(l);△H=﹣285.8kJ/molCO(g)+ O2(g)=CO2(g);△H=﹣283.0kJ/molC8H18(l)+
O2(g)=CO2(g);△H=﹣283.0kJ/molC8H18(l)+ O2(g)=8CO2(g)+9H2O(l);△H=﹣5518kJ/molCH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=﹣890.3kJ/mol
O2(g)=8CO2(g)+9H2O(l);△H=﹣5518kJ/molCH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=﹣890.3kJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是()
A. H2(g) B. CO(g) C. C8H18(l) D. CH4(g)
考点: 有关反应热的计算.
专题: 化学反应中的能量变化.
分析: 根据热化学方程式的含义来计算等质量的四种物质燃烧放出的热量多少;设H2、CO、C8H18、CH4质量都为m,根据Q= ×△H计算判断.
×△H计算判断.
解答: 解:设H2、CO、C8H18、CH4质量都为m,相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量分别是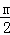 ×285.8kJ=142.9mKJ、
×285.8kJ=142.9mKJ、 ×283kJ≈10.11mKJ、
×283kJ≈10.11mKJ、 ×5518kJ≈48.40mKJ、
×5518kJ≈48.40mKJ、 ×890.3kJ≈55.64mKJ,所以放出热量最少的是CO,
×890.3kJ≈55.64mKJ,所以放出热量最少的是CO,
故选B.
点评: 本题主要考查了反应热的计算,题目难度不大,注意物质的量与热量成正比是解题的关键.


科目:高中化学 来源: 题型:
某溶液中可能有下列阴离子中的一种或几种:SO42﹣、CO32﹣、Cl﹣、OH﹣.
(1)当溶液中有大量H+存在时,则不可能有 存在,发生反应的离子方程式 ;
(2)当溶液中有大量Ba2+存在时,则不可能有 ﹣ 存在,发生反应的离子方程式 ;
(3)检验某溶液中是否存在SO42﹣的试剂为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
足量的铝分别与等物质的量浓度的稀盐酸、氢氧化钠溶液反应,放出的气体在标准状况下体积相等,则所取稀盐酸和氢氧化钠溶液的体积比为( )
A. 3:1 B. 3:2 C. 1:2 D. 6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是()
A. 生成物总能量一定低于反应物总能量
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量
②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量
下列叙述正确的是()
A. 氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B. 氢气和氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C. 氢气和氯气反应生成2mol氯化氢气体,反应的△H=﹣183kJ/mol
D. 氢气和氯气反应生成1mol氯化氢气体,反应的△H=﹣183kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O═O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为()
A. 188kJ B. 436 kJ C. 557 kJ D. 920 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
对于固定体积的密闭容器中进行的气体反应可以说明A(g)+B(g)⇌C(g)+D(g)在恒温下已达到平衡的是()
A. 反应容器的压强不随时间而变化
B. A气体和B气体的生成速率相等
C. A、B、C三种气体的生成速率相等
D. 反应混合气体的密度不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的五中元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22,下列说法正确的是()

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. 物质WY2,W3X4,WZ4均有熔点高,硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
-A.-硫酸和磷酸的摩尔质量相等
-B.-摩尔质量越大,物质的质量越大
-C.-HNO3的摩尔质量是63g
-D.-摩尔质量就等于该物质的相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com