
| A、浓H2SO4和浓盐酸混合可制HCl气体,是利用了浓H2SO4的强酸性 |
| B、SO2使溴水褪色,是利用了SO2的漂白性 |
| C、将SO2、SO3混合气体通入氯化钡溶液中,出现浑浊,是因为有BaSO4生成 |
| D、反应“CuSO4+H2S=CuS↓+H2SO4”能进行,是利用了较强酸制较弱酸的原理 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、钾离子结构示意图: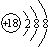 | ||
| B、乙醇的分子式:CH3CH2OH | ||
C、水合氢离子电子式: | ||
D、中子数为18的硫原子:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 环境 | 能够共存的离子 | ||||
| A | 遇pH试纸变红色的溶液 | K+、Cl-、N
| ||||
| B | 有S
| Na+、K+、Cl-、Al3+ | ||||
| C | 加入足量Na2O2的溶液 | Na+、S2-、N
| ||||
| D | FeCl3溶液 | I-、Cl-、S
|
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氯气通入澄清石灰水制取漂白粉 |
| B、电解饱和食盐水溶液制取金属钠 |
| C、SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率 |
| D、用98.3%的浓H2SO4吸收SO3,目的是防止形成酸雾,使SO3吸收完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、3:1 |
| C、1:3 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COONa溶液中 c (Na+)>c (CH3COO-)>c (OH-)>c (H+) |
| B、(NH4)2SO4溶液中:c (SO42-)>c (NH4+)>c (H+)>c (OH-) |
| C、Na2CO3溶液中:c (Na+)>C (CO32-)>C (HCO3-)>c (OH-)>c (H+) |
| D、NaHS溶液中:c (Na+)>C (HS-)>C (S2-)>c (OH-)>c (H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com