

 2NH3↑+CaCl2+2 H2O;
2NH3↑+CaCl2+2 H2O;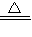 2NH3↑+CaCl2+2 H2O;
2NH3↑+CaCl2+2 H2O;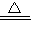 2NH3↑+CaCl2+2 H2O;
2NH3↑+CaCl2+2 H2O;

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
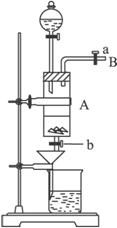
(1)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是__________________________________________________________________。
(2)烧杯内放过量稀HNO3的原因是_______________________________________________,
发生反应的离子方程式是________________________________________________。
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是________
____________________________________________________________________。
(4)利用这个装置进行实验,你认为该实验存在的缺点可能有:
__________________________,__________________________。(写两条即可)
(5)乙同学对该实验进行了改进,他是用空烧杯承接滤液,加入适当的试剂,然后在HCl的气流中、一定温度下蒸发、浓缩、降温结晶而得到纯净的FeCl3·6H2O,你认为加入的试剂可以是_____________。(填序号)①适量氯气 ②适量过氧化氢和稀盐酸 ③高锰酸钾酸性溶液 ④氢氧化钠溶液
在HCl的气流中、一定温度下蒸发、浓缩、降温结晶的理由是__________________________
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
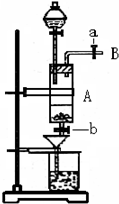
查看答案和解析>>
科目:高中化学 来源:2009年山东省临沂市平邑二中高考化学综合训练卷(一)(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com