
| A.氢化物沸点:HI>HBr>HCl>HF | B.原子半径:K>Cl>S |
| C.分子稳定性:HF>HCl>HBr>HI | D.单质熔点:Li<Na<K<Rb |
科目:高中化学 来源:不详 题型:单选题
| A.酸性: HClO4>H2SO4>H3PO4 |
| B.碱性: NaOH>Mg(OH)2>Al(OH)3 |
| C.原子半径:C>N>O>F |
| D.氢化物稳定性:SiH4>PH3>H2S>HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 (1)元素名称: A C __________ E
(1)元素名称: A C __________ E 
 (2)写出AB2与过量氢氧化钠溶液反应的离子方程式 ;
(2)写出AB2与过量氢氧化钠溶液反应的离子方程式 ; 写出 C2B2与AB2反应的化学方程式
写出 C2B2与AB2反应的化学方程式
 ;
; 
 (3)画出D的原子结构示意图 ,
(3)画出D的原子结构示意图 ,
 用电子式表示化合物 C2D 的形成过程 ;
用电子式表示化合物 C2D 的形成过程 ; (4)D、E的气态氢化物的稳定性 大于 (填化学式)。
(4)D、E的气态氢化物的稳定性 大于 (填化学式)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
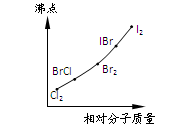
| A.Cl2至BrCl | B.BrCl至Br2 |
| C.Br2至IBr | D.IBr至I2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
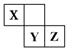
| A.化合物XZ3中各原子均满足8电子的稳定结构 |
| B.X、Y、Z三种元素形成的含氧酸都是强酸 |
| C.常温下,Z单质可与Y的氢化物发生置换反应 |
| D.一定条件下,X2与Al反应得到AlX |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | | | | | a | | b | |
| 3 | c | d | e | f | | g | h | i |
| 4 | j | k | | | | | l | |
| 电离能kJ/mol | I1 | I2 | I3 | I4 |
| d | 738 | 1450 | 7730 | 10550 |
| e | 577 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.从氟到碘,生成的氢化物熔、沸点逐渐升高,稳定性逐渐减弱 |
| B.因为钠原子比铝原子容易失去电子,所以钠比铝的还原性强 |
| C.从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 |
| D.氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的氧化性强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | |
| B | | C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com