
【题目】有一处于平衡状态的反应:2X(s)+Y(g)![]() 2Z(g) △H小于0,为了使平衡向生成Z的方向移动,应选择的条件是( )
2Z(g) △H小于0,为了使平衡向生成Z的方向移动,应选择的条件是( )
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z
A.①③⑤B.②③⑤C.②③⑥D.②④⑥
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,容积不变的容器里,对可逆反应A(g) ![]() 2B(g) +3C(g)的叙述中,能说明反应已达到平衡的是
2B(g) +3C(g)的叙述中,能说明反应已达到平衡的是
A.混合气体的物质的量不再变化B.单位时间消耗a mol A, 同时生成3a molC
C.容器内的气体总质量不再变化D.C生成的速率与B分解的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 按系统命名法, ![]() 的名称为2,6二甲基5乙基庚烷
的名称为2,6二甲基5乙基庚烷
B. 丙氨酸和甘氨酸脱水,最多可生成4种二肽
C. 化合物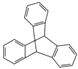 是芳香族化合物
是芳香族化合物
D. 三硝酸甘油酯的分子式为C3H5N3O9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向足量的硫酸溶液中加入200mL 0.4mol/L 的Ba(OH)2溶液,放出10.24kJ的热量。向足量的Ba(OH)2溶液中加入200mL 0.4mol/L 的HCl溶液,放出2.2kJ的热量。则硫酸钠溶液和氯化钡溶液反应的离子的热化学方程式为
A.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -2.92 kJ/mol
B.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -18 kJ/mol
C.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -0.72 kJ/mol
D.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -73 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法正确的是 ( )
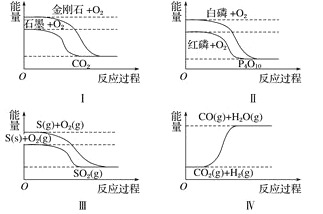
A.金刚石比石墨稳定
B.红磷转变为白磷是吸热反应
C.S(g)+O2(g) === SO2(g) ΔH1 ;S(s)+O2(g) === SO2(g) ΔH2,则ΔH1>ΔH2
D.CO(g)+H2O(g) === CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液。然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。方案如下:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
浓度/(mol·L-1) | 体积/mL | 浓度/(mol·L-1) | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,该反应的离子方程式为______________________,每消耗1 mol H2C2O4转移_____mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥________。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·s-1。
(4)已知50 ℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO4-)~t的变化曲线示意图。_____________
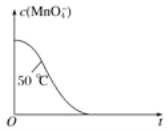
(5)有同学做实验时发现,酸性高锰酸钾溶液与草酸溶液反应开始时,溶液褪色慢,但过了一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出以下的猜想。
猜想a:酸性高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快。
猜想b:________________________________________。
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是__________
A硫酸钾 B硫酸锰 C二氧化锰 D水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g)。测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,下列数据可能存在的是( )
2SO3(g)。测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,下列数据可能存在的是( )
A. SO2、O2浓度分别为0.4 mol·L-1、0.2 mol·L-1
B. SO3浓度为0.25 mol·L-1
C. SO3浓度为0.4 mol·L-1
D. SO3、SO2浓度均为0.15 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
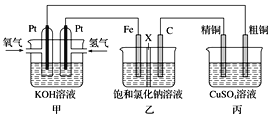
(1)通入氢气的电极为________ (填正极或负极),该电极反应式为________。
(2)石墨电极为________ (填阳极或阴极),乙中总反应化学方程式为________;如果把铁电极和石墨电极交换,乙溶液左侧出现的现象是_________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”“减小”或“不变”)。
(4)若甲中消耗0.01mol O2,丙中精铜增重_________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,两种碳酸盐MCO3(M表示X2+或Y2+)的沉淀溶解平衡曲线如图所示。已知:![]() ,
,![]() ,
,![]() 。
。
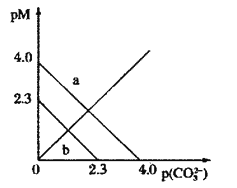
下列说法正确的是( )
A.线a表示YCO3的溶解平衡曲线
B.![]()
C.t℃时,向XCO3悬浊液中加入饱和![]() 溶液,可能有YCO3生成
溶液,可能有YCO3生成
D.t℃时,向饱和YCO3溶液中加入Na2CO3溶液,一定能产生YCO3沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com