

| A. | 原子半径:Br>Se | |
| B. | 还原性:H2Se>HBr | |
| C. | Se在元素周期表中位于第四周期第六族 | |
| D. | 在Se2Br2分子中只含有极性键 |
分析 A.位于同周期,原子序数大的半径小;
B.非金属性越强,对应氢化物越稳定;
C.由原子结构可知元素的位置;
D.Se2Br2分子的结构为Br-Se-Se-Br.
解答 解:A.位于同周期,原子序数大的半径小,则原子半径:Se>Br,故A错误;
B.非金属性越强,对应氢化物越稳定,则还原性:H2Se>HBr,故B正确;
C.由原子结构可知元素的位置,则Se在元素周期表中位于第四周期第ⅥA族,故C错误;
D.Se2Br2分子的结构为Br-Se-Se-Br,含Br-Se极性键和Se-Se非极性键,故D错误;
故选B.
点评 本题考查元素周期表结构及应用,为高频考点,把握元素的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
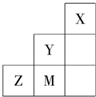
| A. | M、Z可形成ZM2分子 | B. | X原子最外层达到8电子结构 | ||
| C. | 原子半径:Z>M>Y | D. | Z2-的结构示意图可表示为 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为C和Si是同主族元素,故CO2和SiO2形成的晶体相同 | |
| B. | 在晶体中有阳离子就一定有阴离子 | |
| C. | 由于水分子间可以形成氢键故水分子的稳定性很强 | |
| D. | 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 配制一定物质的量浓度的溶液,定容时俯视刻度线,会使所配溶液浓度偏高 | |
| C. | 二氧化硅不与强酸反应,可用石英作为反应容器制取氢氟酸 | |
| D. | 燃着的镁条伸入盛满二氧化碳的集气瓶中,不能继续燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA 族元素单质的熔点随着原子序数递增而升高 | |
| B. | 卤族元素单质的熔点随着原子序数递增而升高 | |
| C. | 第ⅤA族元素的气态氢化物沸点随着原子序数递增而升高 | |
| D. | 第三周期元素形成的简单离子半径随着原子序数递增而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
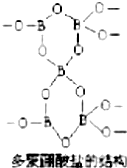 有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )
有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )| A. | 3,9 | B. | 2,4 | C. | 2,5 | D. | 3,6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Na+)=2c(CO32-) | B. | c(H+)>c(OH-) | C. | c(CO32-)>c(HCO3-) | D. | c(CO32-)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com