
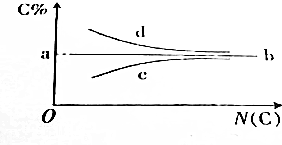
| A. | a点的值肯定是85.7% | B. | 满足b线走势的烃通式为CnH2n | ||
| C. | 满足c线走势的烃一定是烷烃 | D. | 满足d线走势的烃一定是炔烃 |
分析 烷烃的含碳量随碳原子数的递增而增大,其中CH4 含碳 量 为 75%( 最 低 ),CnH2n+2 当n为无穷大时,含碳量为 $\frac{12n}{12n+2n+2}$×100%=$\frac{12n}{14n}$×100%=85.7%;
烯烃的含碳量随碳原子数的递增不变,恒定为 $\frac{12n}{14n}$×100%=85.7%;
炔烃的含碳量随碳原子数的递增而减少,其中C2H2含碳量为$\frac{24}{26}$×100%=92.3%(最大),CnH2n-2当n为无穷大时,含碳量为$\frac{12n}{12n+2n-2}$×100%=$\frac{12n}{14n}$×100%=85.7%,苯的同系物通式为CnH2n-6,当n为无穷大时,含碳量为85.7%;
以此来解题.
解答 解:烷烃的含碳量随碳原子数的递增而增大,其中CH4 含碳 量 为 75%( 最 低 ),CnH2n+2 当n为无穷大时,含碳量为 $\frac{12n}{12n+2n+2}$×100%=$\frac{12n}{14n}$×100%=85.7%;
烯烃的含碳量随碳原子数的递增不变,恒定为 $\frac{12n}{14n}$×100%=85.7%;
炔烃的含碳量随碳原子数的递增而减少,其中C2H2含碳量为$\frac{24}{26}$×100%=92.3%(最大),CnH2n-2当n为无穷大时,含碳量为$\frac{12n}{12n+2n-2}$×100%=$\frac{12n}{14n}$×100%=85.7%,苯的同系物通式为CnH2n-6,当n为无穷大时,含碳量为85.7%;
A.a点的值是85.7%,故A正确;
B.CnH2n满足b线走势,故B正确;
C.炔烃的含碳量随碳原子数的递增而减少,其中C2H2含碳量为$\frac{24}{26}$×100%=92.3%(最大),CnH2n-2当n为无穷大时,含碳量为$\frac{12n}{12n+2n-2}$×100%=$\frac{12n}{14n}$×100%=85.7%,苯的同系物通式为CnH2n-6,当n为无穷大时,含碳量为85.7%,故C正确;
D.苯的同系物通式为CnH2n-6,当n为无穷大时,含碳量为85.7%,满足d线走势,故D错误.
故选D.
点评 本题考查各类烃的含碳量变化规律,难度较大,注意掌握各类烃的含碳量变化规律是解题的关键.


科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验结论 |
| ①NaCl溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计如图系列实验:
某同学为探究元素周期表中元素性质的递变规律,设计如图系列实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com