
| A. | 该氧原子的摩尔质量为$\frac{12b}{a}$g/mol | B. | 1 mol 该氧原子质量为幽a NAg | ||
| C. | xg 该氧原子所含的电子数为$\frac{16x}{a}$ | D. | yg 该氧原子的中子数一定为$\frac{8y}{a}$ |
分析 A.某一原子的相对原子质量是指:以一个碳-12原子质量的$\frac{1}{12}$作为标准,该原子的质量跟一个碳-12原子质量的1/12的比值;
B.NA个氧原子的质量就是1mol该原子质量;
C.氧原子的质子数为8,1个氧原子所含的电子数是8个;
D.氧原子的中子数不一定为8.
解答 解:A.某一原子的相对原子质量是指:以一个碳-12原子质量的$\frac{1}{12}$作为标准,该原子的质量跟一个碳-12原子质量的1/12的比值,故该氧原子的相对原子质量为$\frac{12a}{b}$,即该氧原子的摩尔质量为$\frac{12a}{b}$g/mol,故A错误;
B.氧原子的质量为ag,NA个氧原子的质量为aNAg,故B正确;
C.一个该氧原子的质量是a,xg该氧原子个数为X/ag.1个氧原子所含的中子数是8个,则xg该氧原子所含的电子数为$\frac{8x}{a}$,故C错误;
D.氧原子有多种,中子数不一定是8,故D错误.
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
| A. | 用石墨作电极电解AlC13溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+═2Mn2++4 O2↑+6H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br -+2NO3-+8H+═3Br2+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2 $\stackrel{光照}{→}$ CH3Cl+HCl | B. | CH2═CH2+Br2→CH2BrCH2Br | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 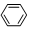 +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$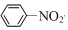 +H2O +H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “尿毒症”患者做血液透析治疗 | |
| B. | FeCl3溶液中滴入NaOH溶液出现红褐色沉淀 | |
| C. | 在河流入海处易形成沙洲 | |
| D. | 在豆浆中加入盐卤制豆腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | |
| pH | 11 | 11 | 3 | 3 |
| A. | 分别加水稀释10倍,四种溶液的pH为:①>②>③>④ | |
| B. | 温度上升10℃,四种溶液的pH不变 | |
| C. | ③④中分别加入适量的氯化按晶体后,③的pH减小,④的pH不变 | |
| D. | 将①④两种溶液等体积混合,所得溶液中c (C1-)>c NH4+)>c (H+)>c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 利用图1装置可定量测定H2O2的分解速率 | |
| B. | 图2中E1表示使用催化剂后的反应热 | |
| C. | 图3表示在平衡体系FeCl3+3KSCN?Fe(SCN)3+3KCl的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象 | |
| D. | 图4表示弱电解质在水中建立电离平衡的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com