
【题目】下列实验不能达到实验目的的是
|
|
A、研究浓度对反应速率的影响 | B、研究阳离子对 |
|
|
C、研究沉淀的转化 | D、研究酸碱性对平衡移动的影响 |
A. A B. B C. C D. D
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
1 | 100 | 17.2 | 2.24 |
2 | 200 | 8.00 | 4.48 |
3 | 400 | 0 | V |
下列说法正确的是( )
A. 表中V=7.84 L
B. 原混合物粉末的质量为25.6 g
C. 原混合物粉未中铁和铜的物质的量之比为2:3
D. 实验3所得溶液中硝酸的物质的量浓度为0.875 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)研究有机物的方法有很多,常用的有①核磁共振氢谱②蒸馏③重结晶④萃取⑤红外光谱⑥过滤,其中用于分子结构确定的有____(填序号)。
(2)下列物质中,其核磁共振氢谱中只有一个吸收峰的是____(填字母)。
A.CH3CH3 B.CH3COOH
C.CH3COOCH3 D.CH3OCH3
(3)某含碳、氢、氧三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是________。如图是该有机物的质谱图,则其相对分子质量为______,分子式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置中,A是氯气发生装置,C、D 为气体净化装置(C中装有饱和食盐水;D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液。

试回答:
(1)实验室制氯气的化学方程式:_______________________________;
(2)C装置的作用是________________;D 装置的作用是__________________;E中发生化学反应的方程式为:_____________________________。
(3)烧杯G 中装有氢氧化钠溶液的作用是___________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①Na2O、Fe2O3、Al2O3属于碱性氧化物,CO2、SiO2、NO2属于酸性氧化物
②碳酸钠、氢氧化钡、氯化铝、过氧化钠都属于离子化合物
③漂白粉、水玻璃、Fe(OH)3胶体、冰水混合物均属于混合物
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤硅导电,食盐水导电均属于物理变化
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法淡化海水的原理如图所示。已知海水中含![]() 等离子,电极为惰性电极。下列叙述正确的是
等离子,电极为惰性电极。下列叙述正确的是
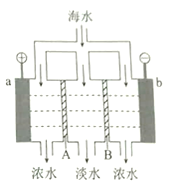
A. A是阳离子交换膜
B. 海水中阴离子移向b电极
C. a的电极反应为![]()
D. b极产生无色气体,出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有![]() 的四种溶液:①
的四种溶液:①![]() ②
②![]() ③
③![]() ④
④![]()
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因:__________.
(2)溶液②的![]() _____________。
_____________。
(3)溶液②、③等体积混合后,溶液中![]() ________
________![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2 广泛用于造纸工业、污水处理等。工业上生产NaClO2 的工艺流程如下:
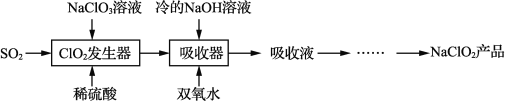
ClO2发生器中的反应为SO2 + 2NaClO3 + H2SO4 = 2ClO2↑+ 2NaHSO4
(1)NaClO3中Cl的化合价_______,上述反应中氧化剂是_______ ,被氧化的元素为_______。请用双线桥法表示该反应中电子转移的方向和数目SO2 + 2NaClO3 + H2SO4 = 2ClO2↑+ 2NaHSO4_______________________反应后,若产生0.6 mol气体,则电子转移的物质的量为 _______mol。
(2)吸收器中反应温度不能高于5℃的可能原因有 _______
(3)反应结束后,向ClO2发生器中通入一定量空气的目的是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是

A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.该分子中的所有碳原子不可能共平面
D.1mol此物质分别与浓溴水和H2反应时最多消耗Br2和H2为4mol和7mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com