
【题目】(1)氯碱工业是以惰性电极电解饱和食盐水,制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
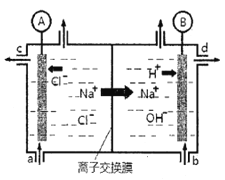
完成下列填空:
①写出电解饱和食盐水的离子方程式_________。
②离子交换膜的作用为:__________、__________。
③氢氧化钠溶液从图中_____位置流出。(选填a、b、c或d)
(2)已知在强碱性环境中,Fe(OH)3可与KClO溶液作用而生成FeO42-。
①此反应的离子方程式是_________。
②高铁电池是一种新型的充电电池,总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,放电时每转移6mol电子,有_____mol K2FeO4被还原,放电时负极附近溶液的pH_________ (填增大”、“减小”或“不变”); 充电时阳极反应式为:_____。
3Zn(OH)2+2Fe(OH)3+4KOH,放电时每转移6mol电子,有_____mol K2FeO4被还原,放电时负极附近溶液的pH_________ (填增大”、“减小”或“不变”); 充电时阳极反应式为:_____。
【答案】 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 阻止OH-进入阳极室,与Cl2发生副反应 阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸 d 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O 2 减小 Fe(OH)3+5OH--3e-=FeO42-+4H2O
Cl2↑+H2↑+2OH- 阻止OH-进入阳极室,与Cl2发生副反应 阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸 d 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O 2 减小 Fe(OH)3+5OH--3e-=FeO42-+4H2O
【解析】(1)①电解饱和食盐水的反应为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,对应的离子方程式为:2Cl-+2H2O
Cl2↑+H2↑+2NaOH,对应的离子方程式为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
②使用阳离子交换膜进行电解,主要是为了解决两个问题:1、电解生成氢气和氯气,两种气体接触可能会发生爆炸;2、随着电解的进行,溶液显碱性,而电解生成的氯气如果和碱接触就会发生反应。因此,答案为:阻止OH-进入阳极室,与Cl2发生副反应;阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
③阴极上水电离的氢离子得电子转化为氢气,剩余水电离的氢氧根离子,同时阳极的钠离子穿过阳离子交换膜进入阴极,所以在阴极得到大量的氢氧化钠,所以氢氧化钠从d口流出。
(2)①强碱性环境中,Fe(OH)3可与KClO溶液作用而生成FeO42-,同时KClO化合价降低,一定转化为KCl。碱性条件,反应物中应该有氢氧根离子,根据化合价升降相等、电荷守恒和原子个数守恒得到方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。
②高铁电池是一种新型的充电电池,总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,所以负极一定是单质锌失电子,因为总反应得到氢氧化锌,所以负极反应为:Zn-2e- + 2OH- = Zn(OH)2,总反应减去负极反应得到正极反应:FeO42-+4H2O+3e-= Fe(OH)3+5OH-。由上,放电时每转移6mol电子,根据正极反应得到有2mol K2FeO4被还原;根据负极反应,放电时负极消耗氢氧根离子,所以pH减小;将放电的正极反应倒过来就是充电的阳极:Fe(OH)3+5OH--3e-=FeO42-+4H2O。
3Zn(OH)2+2Fe(OH)3+4KOH,所以负极一定是单质锌失电子,因为总反应得到氢氧化锌,所以负极反应为:Zn-2e- + 2OH- = Zn(OH)2,总反应减去负极反应得到正极反应:FeO42-+4H2O+3e-= Fe(OH)3+5OH-。由上,放电时每转移6mol电子,根据正极反应得到有2mol K2FeO4被还原;根据负极反应,放电时负极消耗氢氧根离子,所以pH减小;将放电的正极反应倒过来就是充电的阳极:Fe(OH)3+5OH--3e-=FeO42-+4H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法中,正确的是
A.与铝反应产生H2的溶液一定呈酸性
B.钠与硫酸铜溶液反应后置换出红色的铜
C.次氯酸具有强氧化性,可用于自来水的杀菌消毒
D.二氧化硅不与任何酸反应,可用石英制造耐酸容器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容密闭容器中发生反应: A(s) +2B(g)![]() C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是
C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③各气态物质的物质的量浓度
④气体的总物质的量 ⑤混合气体的平均相对分子质量
A. ②③⑤ B. ①②③ C. ②③④⑤ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀B(OH)2溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液POH[POH=-lgc(OH)-]变化的关系如图,以下说法正确的是
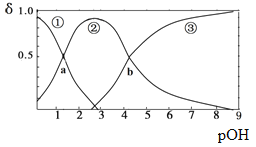
A. 交点a处对应加入的盐酸溶液的体积为5mL
B. 当加入的盐酸溶液的体积为10mL时存在c(Cl-)>c(B(OH)+)>c(H+)>c(OH-)>c(B2+)
C. 交点b处c(OH)=6.4×10-5
D. 当加入的盐酸溶液的体积为15mL时存在:c(Cl-)+c(OH-)= c(B2+)+c(B(OH)+)+ c(H+),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氧(NOCl)是有机合成中的重要试剂,工业上可由NO与Cl2反应制得,回答下列问题:
(1)NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_______
(2)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰气,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+NOCl(g) ΔH1 K1;
NaNO3(s)+NOCl(g) ΔH1 K1;
4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH2 K2;
2NaNO3(s)+2NO(g)+Cl2(g) ΔH2 K2;
2NO(g)+Cl2(g)![]() 2NOCl(g) ΔH3 K3;
2NOCl(g) ΔH3 K3;
则ΔH3=_____(用ΔH1和ΔH2表示),K3=______(用K1和K2表示)
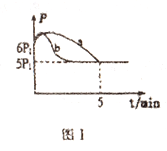
(3)25℃时,向2L带气压计的恒容密闭容器中通入0.08molNO和0.04molCl2发生反应:2NO(g)+Cl2(g)=2NOCl(g)ΔH
①测得其压强(p)随时间(t)的变化如图I曲线a所示(反应达到平衡时的温度与起始温度相同),则ΔH___0(填“>”或“<”);若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图I曲线b所示,则改变的条件是______。
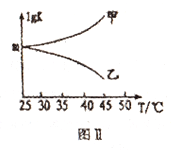
②图Ⅱ是甲、乙同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是______ (填“甲”或“乙”);m值为_______
(4)NO可用间接电化学法除去,其原理如图3所示
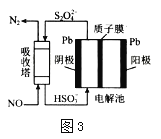
①阴极的电极反应式为_________
②吸收塔内发生反应的离子方程式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁是常见的两种金属,它们的单质及化合物在生活生产中处处可见。
(1)过量的铁和稀硝酸发生反应,产物是Fe(NO3)2和NO,写出该反应的化学方程式_________________________________________________。
(2)实验室配制FeSO4溶液时,如果没有隔绝空气,FeSO4会被氧化为___________(填化学式)。在该溶液中加入___________试剂,看到_____________________现象,证明溶液变质。
(3)已知:Ba(AlO2)2可溶于水,下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。

由图可知c点的沉淀是___________(填化学式),已知a-b时存在的沉淀是Al(OH)3和BaSO4,a点时,n(BaSO4)_____ n(Al(OH)3)(填“>”“<”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的分类中依次按照强电解质、弱电解质和非电解质排列全部正确的组合是()
A.NaCl HF Cl2B.NaHCO3 NH3·H2O CCl4
C.Ba(OH)2 HCl CuD.AgCl H2SO4 C2H5OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com