
| A. | 盐酸能导电,所以盐酸是电解质 | |
| B. | 纯碱的化学式:NaOH | |
| C. | 碳酸钾的电离方程式:K2CO3=2K+1+CO3-2 | |
| D. | 氯离子的结构示意图为: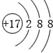 |
分析 A.盐酸为混合物,混合物既不是电解质,也不是非电解质;
B.纯碱为碳酸钠,氢氧化钠为火碱、烧碱、苛性钠;
C.钾离子和碳酸根离子的表示方法错误;
D.氯离子的核电荷数为17,核外电子总数为18,最外层满足8电子稳定结构.
解答 解:A.盐酸为混合物,单质和混合物不属于电解质和非电解质,故A错误;
B.纯碱为碳酸钠,其化学式为:Na2CO3,而NaOH的俗名为烧碱、苛性钠,故B错误;
C.碳酸钾为强电解质,在溶液中完全电离,其正确的电离方程式为:K2CO3=2K++CO32-,故C错误;
D.氯离子的核电荷数为17,最外层达到8电子稳定结构,其离子结构示意图为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电离方程式、离子结构示意图、电解质与非电解质等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
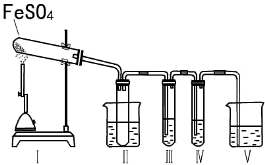
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用粮食发酵制取 | B. | 可由乙烯通过加成反应制取 | ||
| C. | 与乙醛互为同分异构体 | D. | 通过取代反应可以制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性强弱:KOH>NaOH>LiOH | B. | 原子半径大小:Na>S>O | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 金属性强弱:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖可以水解成乙醇 | B. | 石油裂解气产物可用于制备塑料 | ||
| C. | CH2═CH2和CH3CH2Cl 都属于烃 | D. | 蛋白质、油脂均属高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①⑤ | C. | ②④ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol乙醇完全燃烧生成3mol水 | |
| B. | 乙醇能与水以任意比例互溶 | |
| C. | 乙醇沸点较高 | |
| D. | 0.1mol乙醇与足量金属钠反应生成0.05molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
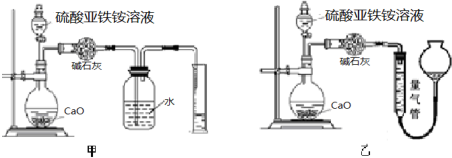
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com