
| A、溶液中导电粒子的数目增加,导电性增强 | ||
| B、醋酸的电离程度增大,c(H+)亦增大 | ||
| C、再加入10mLpH=11NaOH溶液,混合液pH=7 | ||
D、溶液中
|
| c(CH3COO-) |
| c(CH3COOH)?c(OH-) |
| c(CH3COO-)×c(H+) |
| c(CH3COOH)×KW |
| Ka |
| KW |
| c(CH3COO-) |
| c(CH3COOH)?c(OH-) |


科目:高中化学 来源: 题型:
 台湾的食品中“塑化剂”是一种塑料中的添加剂,不是食品添加剂,会危害男性生殖能力,促使女性性早熟,会伤害人类基因.因此不能用于食品当中,而且用了增塑剂的包装材料或者容器不能用于包装脂肪性的食品.有关说法正确的是( )
台湾的食品中“塑化剂”是一种塑料中的添加剂,不是食品添加剂,会危害男性生殖能力,促使女性性早熟,会伤害人类基因.因此不能用于食品当中,而且用了增塑剂的包装材料或者容器不能用于包装脂肪性的食品.有关说法正确的是( )| A、“塑化剂”能溶于水 |
| B、“塑化剂”是邻苯二甲酸酯,它水解可以生成邻苯二甲酸和醇 |
| C、该物质为高分子化合物 |
| D、应推广使用聚氯乙烯塑料袋包装食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释溶液,水解程度减小 | ||||||
| B、通入CO2,平衡朝正反应方向移动 | ||||||
C、升高温度,
| ||||||
| D、加入NaOH固体,溶液PH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
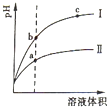 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )| A、Ⅱ为盐酸稀释时pH变化曲线 |
| B、导电性:b点>c点 |
| C、Kw的数值:a点>c点 |
| D、酸的总浓度:b点>a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V3>V2=V1 |
| B、V3=V2=V1 |
| C、V3>V2>V1 |
| D、V1=V2>V3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| B、某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| C、向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| D、将SO2通入品红溶液,溶液褪色后加热恢复原色,将SO2通入溴水,溴水褪色后加热也能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.84L |
| B、8.96L |
| C、15.68L |
| D、17.92L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com